Производство серной кислоты
Серная кислота – самая дешевая из минеральных кислот. Ее производ-ство в России в 1993 г. составляло 8,2 млн. т. Свойства серной кислоты: плотность – 1,85 г/см 3 при 0 о С;
t кип – 296 о С, с водой смешивается в любых соотношениях с выделением боль-шого количества тепла. Очень химически активна: растворяет окислы метал-лов и большинство чистых металлов, вытесняет все другие кислоты из их со-лей. Обладает высокой водоотнимающей способностью. Дерево и другие рас-тительные и животные ткани разрушаются в концентрированной серной ки-слоте.
Применение серной кислоты: производство минеральных удобрений, цветная металлургия, травление металлов, получение красителей, лаков, кра-сок и других органических веществ.
Способы получения :
1.Термическим разложением железного купороса (открыт в ХIII в)
2.Нитрозный метод (используется 200 лет)
3.Контактный метод (используется менее 100 лет) в настоящее время вытеснил все остальные. Этим методом производится более 80% серной кислоты.
Производство серной кислоты контактным методом
Основные стадии производства серной кислоты:
1.Получение двуокиси серы
2.Очистка двуокиси серы
3.Окисление двуокиси серы в серный ангидрид
4.Получение олеума
I.Получение so2
Сырье для производства SO 2 – самородная сера, пирит, медный колчедан; сульфаты кальция и натрия.
Получение двуокиси серы из пирита.
Пирит имеет формулу FeS 2 . Из пирита получают до 40% серной кисло-ты, он содержит до 50% серы и до 40% железа. Если пирит содержит большое количество цветных металлов, то его подвергают флотационному обогащению с получением сульфидов цветных металлов и пирита.
Для получения двуокиси серы пирит обжигают в печах различной конст-рукции. При этом идут следующие реакции:
4 FeS 2 +11O 2 → 2Fe 2 O 3 + 8 SO 2 + 3400 кДж
Этот процесс состоит из нескольких стадий:
При температуре более 500 о С идет диссоциация пирита:
2 FeS 2 → 2FeS + S 2 после чего сера быстро сгорает
S 2 +2O 2 → 2 SO 2
Оставшийся FeS окисляется:
4 FeS + 7O 2 → Fe 2 O 3 + 4 SO 2
При обжиге пирита 5-10% серы переходит в SO 3
2 SO 2 +O 2 → 2SO 3
Для обжига пирита используют печи:
Механические полочные – это универсальные печи, которые могут ис-пользоваться для обжига любого сыпучего материала. При обжиге пирита по-лучают газ следующего состава: SO 2 -10%, O 2 -9%, N 2 -82%. При t > 850 0 С пирит спекается в куски, что нежелательно. Поэтому обжиг ведут при темпера-туре не более 850 0 С. запыленность газа составляет не более 10 г/м 3 .
Недостатки механических полочных печей: они сложны в устройстве и дороги, не обеспечивают полного выжигания серы, получается газ с низкой концентрацией SO 2 , в пиритном огарке остается до 2% серы.
Печи пылевидного обжига можно использовать только для сухого флота-ционного колчедана, который подается в печь с помощью форсунки. Сгорание идет намного интенсивнее, а возможность спекания меньше, поэтому можно использовать температуру до 1100 0 С – это позволит подавать меньший избы-ток воздуха. Концентрация SO 2 ≤ 13%, в огарке остается до 1,5% серы. Отхо-дящие газы имеют температуру около 1000 0 С и подаются в котел утилизатор для получения пара.
Недостатки печей пылевидного обжига: необходимость применения кол-чедана с малой влажностью, высокая запыленность газа (до 100 г/м 3).
Печи кипящего слоя и спользуются для обжига как флотационного, так и рядового колчедана. Концентрация частиц в объеме воздуха больше, чем в пылевидных печах. Обжиг ведется при температуре 800 0 С. Концентрация SO 2 в газе до 15%, в огарке остается около 0,5% серы. Печи просты в устройстве и высокопроизводительны. В настоящее время находят все более широкое при-менение.
Недостатки печей кипящего слоя: высокое содержание пыли (до 200 г/м 3) необходимость использования частиц близких по размеру.
Использование серы для получения двуокиси серы.
Серу сначала плавят глухим паром, отфильтровывают от механических примесей и подают через форсунку в печь. При этом сера испаряется и сгора-ет.
Кроме форсуночных используют также циклонные печи, где за счет тан-генциального подвода воздуха интенсивность перемешивания и сгорания серы выше, чем в форсуночных. Поэтому в настоящее время циклонные печи вы-тесняют форсуночные.
2.Очистка газа от пыли.
Грубая очистка производится в циклонах и пылеосадительных камерах, кото-рые устанавливаются после печей. Доочистка проводится в промывных баш-нях и мокрых электрофильтрах.
3.Контактное окисление двуокиси серы в серный ангидрид - э то процесс гетерогенный каталитический, то есть реагирующие вещества и катализатор находятся в разных фазовых состояниях. В данном случае реагирующие веще-ства – газы, а катализатор находится в твердом состоянии. На катализаторе идет следующая реакция:
2 SO 2 + O 2 ↔ 2SO 3 +190 кДж.
Для того, чтобы повысить выход SO 3. необходимо повышать давление и пони-жать температуру, однако при понижении температуры уменьшается скорость реакции. Поэтому для обеспечения достаточно высокой скорости реакции процесс ведут при температуре не менее 450 0 С.
Дополнительно используют катализаторы. Известны сотни веществ, ко-торые ускоряют эту реакцию. Лучшими являются Pt, FeO, V 2 O 5 . Наиболее ак-тивна платина, но она очень дорога и легко окисляется примесями, содержа-щимися в обжиговом газе, особенно мышьяком. Поэтому обычно используют V 2 O 5 . Он менее активен, но намного дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина. Ванадиевая контактная масса содержит 7% V 2 O 5 в качестве активатора – оксид калия, а носителем являются пористые алюмосиликаты. Катализатор используют в виде таблеток при t=400-600 0 С. При t > 600 0 С происходит необратимое падение активности катализатора, вследствие спекания активных компонентов с образованием не-активных соединений. При t < 400 0 С активность катализатора тоже падает.
Процесс катализа идет в несколько стадий:
1.Диффузия компонентов из ядра газового потока к гранулам, и внутрь пор контактной массы
2.Сорбция кислорода катализатором.
3.Сорбция молекул SO 2 с образованием комплекса SO 2 * O * Kt
4.Перегруппировка электронов с образованием комплекса SO 3 * Kt
5.Десорбция SO 3
6.Диффузия SO 3 из зерен катализатора в газовый поток.
При использовании крупных гранул катализатора общая скорость про-цесса определяется диффузией (1,6 стадии) поэтому обычно используют гра-нулы диаметром не более 5 мм, и в этом случае лимитирующей является сорбция молекул SO 2 (2 стадия). Срок службы катализатора около 4 лет.
Технологическая схема производства серной кислоты .
Технологическая схема производства серной кислоты представлена на рис.1. Сернистый газ из печи обжига поступает на очистку сначала в циклон 1, а за-тем в сухой электрофильтр 2: температура газа на выходе из электрофильтра около 300 0 С. Затем газ поступает в полую промывную башню 3 , где разбрыз-гивается холодная серная кислота с концентрацией 75%. При охлаждении газа, содержащиеся в нем SO 3 и пары воды конденсируются в виде мельчайших ка-пелек, в которых растворяется окись мышьяка. В результате образуется мышьяково-кислотный туман, который улавливается в полой башне 3 и в баш-не с насадкой 4. Одновременно улавливаются остатки пыли, селен и другие примеси. Окончательная очистка SO 2 производится в мокрых электрофильтрах
5. Обычно устанавливается последовательно 2-3 фильтра. Очистка газа закан-чивается его осушкой от паров воды концентрированной серной кислотой в башне с насадкой 6.
Аппараты для очистки газа изготавливаются из нержавеющей стали и дополнительно футеруются кислотоупорным кирпичом.
Сухие SO 2 и SO 3 не агрессивны, поэтому остальные аппараты можно монтировать из обычной стали. Сухой SO 2 поступает в контактный узел, кото-рый состоит из:
Контактного аппарата 7
Теплообменника 8
Пускового огневого подогревателя газа, который служит для подогрева газа при пуске установки или падении температуры.
Газ в контактный узел подают турбокомпрессором 9. Контактный аппа-рат представляет собой цилиндр диаметром 3-12 м, высотой 10-25 м. Внутри корпуса устанавливают 4-5 решеток со слоем гранул контактной массы. Меж-ду решетками устанавливают теплообменники.
Свежий газ подогревается за счет тепла прореагировавшего горячего газа во внешних теплообменниках, а потом во внутренних теплообменниках на-гревается до t = 440-450 0 С, после чего поступает в первый слой контактной массы. После каждого слоя контактной массы газ проходит через один из внутренних теплообменников для охлаждения. После контактного аппарата газ поступает на абсорбцию в башни с насадкой 11,12. Абсорбентом является в башне 11 - олеум, а в башне 12 – 98,3% -ная серная кислота, которая обладает наилучшей абсорбционной способностью.
Абсорбцию
ведут концентрированной серной кислотой,
так как, если погло-щение проводить
водой, сернистый ангидрид будет
взаимодействовать с пара-ми воды с
образованием сернокислого тумана,
который очень трудно уловить.


Абсорбция сернистого ангидрида сопровождается выделением большого количества тепла, в результате чего кислота разогревается и абсорбция замед-ляется, поэтому для улучшения абсорбции газ и кислоту охлаждают в тепло-обменнике. Количество орошающей кислоты во много раз больше, чем нужно для поглощения сернистого ангидрида, и это количество определяется тепло-вым балансом.
Метод двойного контактирования
Степень превращения SO 2 в SO 3 в контактном аппарате составляет 90%. Оста-точное содержание SO 2 в отходящих газах составляет до 1,5%, что значитель-но выше ПДК. Поэтому отходящие газы из абсорбера подают снова в контакт-ный аппарат. В результате увеличивается соотношение O 2 к SO 2 и степень превращения составляет уже 95-97%, а содержание SO 2 в отходящих газах со-ставляет около 0,003%.
Утилизация твердых отходов сернокислотного производства
Твердыми отходами производства серной кислоты являются:
1. Пиритные огарки;
2. Пыль циклонов и сухих электрофильтров;
3. Шламы промывных башен и мокрых электрофильтров.
Переработка пиритных огарков
В результате обжига 1 т пирита образуется 0,55 т пиритного огарка, ко-торый содержит 40- 63% железа, 1-2% серы, 0,33-0,47% меди; 0,42-1,35% цин-ка, а также драгоценные металлы в количестве 10-20 г/т. Извлечение цветных металлов из огарка
Хлорирующий обжиг используется в том случае, если содержание меди превышает 0,5%. Использование этого метода позволяет извлечь 85-90% меди, значительную долю благородных металлов, а также обеспечивает практически полное обессеривание огарка. Стоимость получаемой меди покрывает расходы на переработку огарка.
Перед обжигом к огарку примешивают до 20% размолотого хлорида на-трия. В процессе обжига образуется хлорид меди. Оптимальная температура обжига составляет 550-600 0 С. При температуре менее 530 0 С в шихте образу-ется водорастворимый сульфат железа, который мешает последующему выще-лачиванию меди. При температуре более 600 0 С резко падает выход основных продуктов.
Условия оптимального протекания процесса:
Перемешивание шихты;
Достаточное содержание серы в огарке. Сера необходима для перевода хлорида натрия в сульфат натрия. Если серы мало, то добавляют колчедан.
Для того, чтобы процесс начался и шел автотермично, достаточно смесь подогреть до температуры 200-300 0 С.
Химизм процесса
Процесс и дет в 3 стадии:
На первой стадии происходит окисление сульфидов и образование хло-рида железа (Ш):
2MeS + 3O 2 → 2MeO + 2 SO 2
MeO + SO 2 + 0,5O 2 → MeSO 4
SO 2 + 0,5 O 2 → SO 3
Fe2 (SO 4) 3 + 6 NaCl → 3Na 2 SO 4 + 2FeCl 3
На второй стадии происходит взаимодействие газовой фазы с шихтой с образованием газообразных хлорирующих агентов:
2NaCl + SO 2 + O 2 → Na 2 SO 4 + Cl 2
4NaCl + 2 SO 3 + O 2 → 2Na 2 SO 4 + 2Cl 2
2NaCl + SO 3 + H 2 O → Na 2 SO 4 + 2HCl
4FeCl 3 + 3O 2 →2Fe 2 O 3 + 6Cl 2
2FeCl 3 + 3H 2 O →Fe 2 O 3 + 6HCl
На третьей стадии хлорирующие агенты взаимодействуют с оксидами и сульфидами металлов:
MeS + Cl 2 + 1,5O 2 → MeCl 2 + SO 3
MeS + Cl 2 + O 2 → MeCl 2 + SO 2
MeS + 2HCl + 1,5O 2 → MeCl 2 + SO 2 + H 2 O
MeO + 2HCl → MeCl 2 + H 2 O
2Me + 3Cl 2 → 2MeCl 3
В результате обжига 85-90% меди превращается в хлорид меди, который хорошо растворяется в воде. Поэтому из обожженной массы медь выщелачи-вают теплой водой в несколько стадий: сначала раствором от предыдущих операций, а затем разбавленной кислотой.
Полученную вытяжку обрабатывают железным скрапом. При этом идет процесс цементации:
CuCl 2 + Fe→ Cu +FeCl 2
Процесс ведут без доступа кислорода, так как в присутствии кислорода происходит образование нерастворимого гидроксида железа(III), который за-грязняет медь.
Отработанный раствор содержит до 100 г/л сульфата натрия. Его выпа-ривают или вымораживают для получения десятиводного сульфата натрия. Выщелоченный огарок просушивают в механических печах до влажности 8-10%, а затем направляют на агломерацию и в доменное производство. 1т огар-ка дает до 20 кг меди и около 900кг агломерата.
Метод хлоридовозгонки . При использовании этого метода огарок обра-батывают хлористым водородом в аппаратах кипящего слоя. При этом в газо-вую фазу в свободном состоянии выделяются хлориды тяжелых металлов.
Хлористый водород может подаваться в газообразном виде, в виде рас-твора соляной кислоты или в виде солей, которые легко разлагаются или гид-ролизуются с образованием хлористого водорода.
В этой технологии используют до трех последовательных аппаратов ки-пящего слоя: в первом аппарате при температуре 600-800 0 С разлагаются все сульфиды. Во втором реакторе огарок вступает во взаимодействие с хлори-стым водородом. В третьем реакторе создают восстановительную среду, бла-годаря чему Fe 2 O 3 переходит в Fe 3 O 4 . При последующем магнитном обогаще-нии огарка содержание железа достигает 70%. Огарок направляют в доменное производство.
Газы, выходящие из второго реактора содержат хлориды цветных метал-лов и избыток хлористого водорода. Их направляют в абсорбер, где образуется концентрированный раствор, из которого металлы извлекают различными способами. Используемый хлористый водород практически полностью реге-нерируется.
Использование огарков в доменном производстве.
Если не проводится извлечение цветных металлов, то пиритный огарок может быть сразу использован в доменном производстве. Однако этому меша-ет повышенное содержание серы (до 3,5%) и высокая степень измельчения.
Для уменьшения содержания серы и укрупнения частиц огарка обычно ис-пользуют агломерацию.
Производство пигментов из огарков и огарковой пыли .
Получение железного сурика . Для получения железного сурика использу-ется несколько методов.
При использовании первого метода для получения железного сурика огарок при нагревании обрабатывают серной кислотой, в результате этого об-разуется сульфат железа, затем полученную суспензию смешивают с алебаст-ром, мелом, глиной и обжигают в печах. В зависимости от температуры обжи-га и вводимых добавок получают пигменты различных оттенков.
Недостатком данной технологии является то, что в железном сурике при-сутствует сера и ее соединения, что делает сурик коррозионно-активным. Та-кой сурик нельзя использовать для покраски металлических поверхностей.

При использовании второго метода, технологическая схема которого представлена на рис.2, для получения железного сурика берут фракцию огарка
0,5-2 мм, наиболее богатую оксидами железа. Эту фракцию подают в шаровую мельницу (2). Измельченный огарок промывают водой в промывном чане (3). При этом удаляются водорастворимые соли железа, цинка и меди, вызывающие коррозию и частично удаляются соединения серы. Промывку проводят горячей водой (60-80 0 С) при перемешивании, которое чередуют с от-стаиванием до исчезновения окраски, вызываемой растворимыми солями.
Отмытый огарок подсушивают глухим паром в сушилке (4) и подают на обжиг при температуре 850-900 0 С во вращающуюся печь (5). Цель обжига – удаление влаги и серы. Полученный после обжига полуфабрикат, который со-держит до 90% Fe 2 O 3 , размалывают в шаровой мельнице (6) и смешивают с наполнителем в смесителе (7). В результате получают железный сурик, кото-рый можно использовать для окраски любых поверхностей.
Получение желтой охры и мумии из огарковой пыли. . Огарковая пыль, осаждаемая в циклонах и электрофильтрах, содержит больше водораствори-мых солей. Ее используют для получения пигментов типа желтой охры и му-мии.
Технологическая схема представлена на рис.3. Для получения пигментов огарковую пыль подают в реактор-растворитель (1), где ее перемешивают с водой в течение 20-25 мин. Для перемешивания используют сжатый воздух. Затем раствор отстаивают 8 часов. Окрашенную жидкую фазу откачивают в смеситель (2), куда добавляют мел и глину. При этом идет реакция
Fe 2 (SO 4) 3 + 3CaCO 3 → Fe 2 O 3 +3CaSO 4 + 3CO 2
В результате получают насыщенный влагой осадок. Его высушивают в сушилке (5) при 80 0 С и подают в шаровую мельницу (4), из которой выходит готовый продукт – сухой минеральный пигмент типа желтая охра.
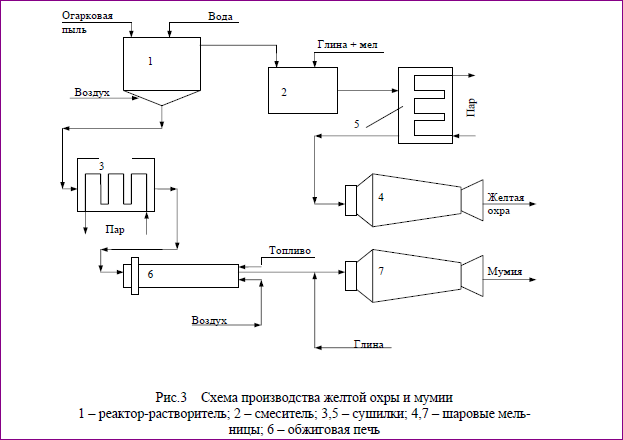
Влажный осадок из реактора-растворителя (1), содержащий 91% Fe 2 O 3 ; 3,7% FeS; 5,3% примесей, сушат при температуре 100 0 С в сушилке (3) и затем передают в печь (6), где при температуре 800-900 0 С выжигается сера. Полу-продукт, содержащий до 95% Fe 2 O 3 , направляется на измельчение в шаровую мельницу (7). Туда же одновременно подают глину. Из мельницы выгружают готовый продукт – минеральный пигмент типа мумии.
Получаемые минеральные пигменты являются стабильными по цвету и неизменяемыми во времени. Масляная краска на их основе не сворачивается, а известковая хорошо схватывается.
Получение селена из шламов промывных башен и мокрых
электрофильтров.
В пирите содержится 0,002-0,02% Se, который является химическим ана-логом серы. Поэтому при обжиге пирита кроме SO 2 образуется SeO 2 . Так как селен встречается в природе в очень малых количествах и концентрациях, шламы сернокислотного производства являются основным сырьем для его по-лучения. Основная часть селена выделяется со шламами в промывных башнях и мокрых электрофильтрах системы очистки обжигового газа.
Механизм выделения селена из обжиговых газов достаточно сложен: при очистке обжигового газа SeO 2 поглощается туманом и каплями орошающей серной кислоты. Растворимость SeO 2 в серной кислоте велика.
Растворяющийся в серной кислоте SO 2 восстанавливает SeO 2:
SeO 2 + 2SO 2 +2Н 2 О → Se + 2Н 2 SO 4
Одновременно идут процессы образования политиоселеновых кислот и селенистой кислоты:
SeO 2 + 3SO 2 +2Н 2 О → Н 2 SеS 2 O 6 + Н 2 SO 4
SeO 2 + Н 2 О → Н 2 SeO 3
Политиоселеновые кислоты и селенистая кислота устойчивы при температуре не более 70 0 С. При более высокой температуре они разлагаются:
Н 2 SeO 3 + 2SO 2 +Н 2 О → Sе +2Н 2 SO 4
Н 2 SеS 2 O 6 → Sе + Н 2 SO 4 + SO 2
Образующийся металлический селен осаждается вместе с частицами пы-ли из кислоты промывных башен в виде шлама. Такой шлам содержит до 5% селена и называется бедным. Также селен осаждается в мокрых электрофильтрах. Из-за низкого содержания пыли содержание селена здесь достигает 50%. Такой шлам называют богатым.
Бедный шлам разбавляют водой и прогревают острым паром для более полного выделения селена. Образовавшуюся пульпу фильтруют и полученный осадок промывают водой и 0,5% раствором соды. Затем шлам сушат при тем-пературе 90-100 0 С. Также обрабатывают и богатый шлам. Затем оба шлама смешивают (содержание селена при этом составляет 10-12%) и подают на об-жиг для извлечения селена. Из 1 т пирита получают 10-50 г селена.
Очистка отходящих газов сернокислого производства
Получение серной кислоты сопровождается образованием аэрозолей и тума-нов. Их улавливают в туманопоглотителях в две ступени:
На первой ступени используют поглотители с грубыми волокнами, что обес-печивает эффективность очистки 90-92%
На второй ступени используют поглотители с тонкими волокнами, что обеспе-чивает эффективность очистки 99,8%
Газовые выбросы SO 2 в производстве составляют до 50 тыс.т./год.
Очистка отходящих газов проводится абсорбцией щелочными растворами. В качестве абсорбентов используют растворы аммиак, соды, известковое моло-ко.
Синтез Аммиака
Азот участвует в основных биохимических процессах, входит в состав белков. Соединения азота используются в производстве минеральных удобре-ний, красителей, пластмасс, химических волокон, медикаментов, взрывчатых веществ. И везде используется не свободный азот, а соединения азота. Источников связанного азота в природе, имеющих промышленное значение крайне мало. Наиболее крупное месторождение селитры расположено в Чили. В на-шей стране таких месторождений нет, что связано с очень высокой раствори-мостью соединений азота и влажным климатом нашей страны.
В то же время огромное количество азота содержится в атмосферном воздухе. Поэтому стали искать способы перевода атмосферного азота в его со-единения.
Синтез соединений азота из молекулярного атмосферного азота был осуществлен в начале ХХ в. тремя методами:
Дуговой метод заключается в том, что при температуре электрической дуги
(2000 0 С) азот взаимодействует с кислородом:
N 2 + O 2 ↔ 2NO – 179,2 кДж.
Этот метод не нашел широкого применения из-за малого выхода NO и громадных затрат электроэнергии на образование электрической дуги.
Цианамидный метод заключается в том, что тонкоизмельченный карбид кальция при температуре около 1000 0 С взаимодействует с азотом по уравне-нию:
CaC 2 +N 2 ↔ СaCN 2 + C + 301кДж
Этот метод также не нашел широкого применения.
Аммиачныйметод заключается в том, что азот взаимодействует с водородом с образованием аммиака по уравнению
N 2 +3H 2 ↔2NH 3 +Q
При использовании этого метода расход энергии намного меньше, чем в первых двух. Поэтому этот метод начал использоваться в промышленных масштабах. Первый завод по производству аммиака был построен в 1913 г. в Германии.
Получение аммиака аммиачным методом
Методы получения азота
Физическое разделение воздуха
Воздух содержит 78,03%-N 2 ; 21%-O 2 ; 0,94%-Ar; и в незначительном количест-ве CO 2 , H 2 , Ne, He, Kr, Xe. Разделение воздуха проводят методом ректифика-ции жидкого воздуха. Метод основан на различии в температурах кипения га-зов, входящих в состав воздуха.
Наиболее сложный этап - перевод воздуха в жидкое состояние. Его про-водят, сочетая глубокое охлаждение с повышением давления.
Методы получения водорода
Конверсиия метана или природного газа происходит следующим образом:
CH 4 + H 2 O пары ↔ CO + 3H 2 – 206 кДж
2СH 4 + O 2 ↔ 2CO + 4H 2 + 70кДж
CO + H 2 O пары ↔ CO 2 + H 2 + 41кДж
Суммарно процесс конверсии метана водяным паром протекает с поглощени-ем энергии:
CH 4 + 2H 2 O пары ↔ CO 2 + 4H 2 – 165 кДж
Конверсию метана ведут при повышенном давлении обычно с использова-нием катализаторов. Содержание метана после конверсии не должно превы-шать 0,5%. Остаточное содержание метана зависит от температуры, соотно-шения H 2 O: CH 4 и давления. При температуре 800-1000 0 С достигается необ-ходимое содержание метана, однако скорость процесса без катализатора очень мала. Поэтому конверсию метана ведут обычно с использованием катализато-ров (никель, нанесенный на оксид алюминия). Хотя с повышением давления содержание метана увеличивается, процесс часто ведут при повышенном дав-лении для увеличения скорости реакции. При этом используется то давление, с которым метан поступает на завод. Это уменьшает расход электроэнергии на последующее сжатие газа при производстве аммиака.
При конверсии окиси углерода объем газа остается постоянным. Поэтому изменение давления не сдвигает равновесия, но увеличивает скорость реакции. Увеличение температуры сдвигает равновесие влево, однако при низких тем-пературах скорость реакции мала даже в присутствии катализатора.
Обычно процесс ведут при t = 200-300 0 С в присутствии Zn-Cr-Cu катализато-ра. Остаточное содержание CO составляет 0,2-0,4%. Данный катализатор очень чувствителен к соединениям серы – их концентрация не должна превы-шать 2 мг/м 3 .
Получение азото-водородной смеси из коксового газа.
Коксовый газ имеет следующий состав:
H 2 – 53%; CH 4 - 23-28%; другие углеводороды - 2-3%; СO-5-7%; CO 2 -1,5-2,5%;
O 2 -0,3-0,8%; N 2 =5%.
Температура кипения азота составляет -195,7 0 С, Температура кипения водо-рода -200 0 С. Все остальные компоненты имеют температуру кипения выше -195 0 С. Поэтому проводят глубокое охлаждение газа до температуры -195 0 С. При этом все компоненты кроме азота и водорода переходят в жидкое состоя-ние. Однако в полученном газе остается некоторое количество окиси углерода, которая является сильным ядом для катализатора. Для удаления окиси углеро-да газ промывают жидким азотом, в котором окись углерода хорошо растворя-ется. При этом часть азота испаряется и достигается соотношение азота к во-дороду близкое к 1:3. Затем добавлением азота смесь доводят точно до соот-ношения 1:3.
Очистка газа
Катализатор синтеза аммиака резко снижается свою активность в присутствии соединений серы и кислорода. В тоже время природный газ содержит соеди-нения серы, а в результате конверсии образуются СO 2 и СO. Содержание СO 2 может достигать 30%, а СО – 4%. Тщательная очистка газа от этих примесей при наименьших затратах – одна из наиболее трудных задач.
Очистка газа от серусодержащих соединений .
Природный газ содержит следующие соединения серы: сероводород, сероуг-лерод CS 2 , сероокись углерода COS, меркаптаны (главным образом этилмер-каптан C 2 H 5 -SH) общее содержание соединений серы составляет 5-30 мг/м 3 . Перед очисткой все соединения серы гидрируют до сероводорода на кобальт-молибденовом катализаторе при t=400-450 0 С
CS 2 + 4H 2 → CH 4 +2 H 2 S
COS + 4H 2 → CH 4 + H 2 S + H 2 O
R – SH + H 2 → RH + H 2 S
Образующийся сероводород абсорбируют или адсорбируют. В качестве адсор-бентов используют: активный уголь, гидроксид железа, окись цинка, в качест-ве абсорбентов – раствор аммиака, мышьяковосодовые растворы, растворы карбонатов натрия и калия. Чаще всего используют окись цинка:
H 2 S + ZnO → ZnS + H 2 O
После абсорбции содержание серы не превышает нормы.
Очистка газа от СO 2
Существует несколько способов очистки газа от СO 2
Водная промывка. При использовании этого метода газ промывают водой в башне с насадкой при давлении 20-30 атм. Вытекающая из башни вода враща-ет турбину, насаженную на одном валу с насосом, подающим воду в башню. Таким образом, регенерируют около 60% энергии. После турбины давление падает до атмосферного, растворимость газов уменьшается и они выделяются в атмосферу. При этом выделяется газ, содержащий 80% СO 2 , 11% H 2 и при-меси – сероводород и азот. Полученный газ используют в качестве «сухого льда». Вода после выделения газа снова возвращается в башню.
Недостатки этого метода: большой расход электроэнергии, большие потери водорода.
Этаноламиновая очистка осуществляется растворами смеси моно- и диэтано-ламинов: (CH 2 – CH 2 - OH)NH 2 – моноэтаноламин, (CH 2 – CH 2 – OH) 2 NH – ди-этаноламин
Процесс удаления CO 2 основан на протекании следующих реакций:
CO 2 + 2RNH 2 + H 2 O ↔ (RNH 3) 2 CO 3
CO 2 + (RNH 3) 2 CO 3 + H 2 O ↔ 2RNH 3 НCO 3
Процесс поглощения проводят при температуре 40-45 0 С. Образовавшиеся кар-бонаты и бикарбонаты разлагаются в десорбере с образованием CO 2 при тем-пературе 120 0 С.
Очистка горячим раствором поташа проводится при давлении 10-20 атм, при температуре 110-120 0 С. Обычно используется 25%-ный раствор поташа, акти-вированный мышьяком. При поглощении CO 2 карбонат превращается в бикар-бонат
K 2 CO 3 + CO 2 + H 2 O ↔ 2KHCO 3
Регенерация проводится при уменьшении давления до атмосферного.
Очистка газа от СO
Поглощение медно-аммиачным раствором. Метод основан на том, что CO абсорбируется медно-аммиачным раствором с образованием комплексного со-единения. Поглотительная способность медно-аммиачных растворов при обычных условиях невелика. Поэтому очистка проводится при давлении 100-300 атм. и температуре
0-15 0 С. Регенерацию ведут при температуре 77-79 0 С и атмосферном давлении. Еще более эффективно регенерация идет под вакуумом. При регенерации по-глотительный раствор теряет часть аммиака, который пополняют. После реге-нерации и охлаждения поглотительный раствор снова подают на поглощение. После очистки остается не более 0,003% CO.
Промывка жидким азотом. При промывке жидким азотом СО растворяется в азоте. Этот метод обычно используется при получении азото-водородной сме-си из коксового газа.
Теоретические основы синтеза аммиака
Синтез аммиака основан на реакции:
N 2 + 3H 2 ↔ 2NH 3 + Q
Реакция экзотермическая. Тепловой эффект реакции зависит от температуры и давления. При температуре 500 0 С, тепловой эффект реакции зависит от тем-пературы и давления:
p=1 атм., Q = 50 кдж/моль
P=100атм.,Q = 52 кдж/моль
P=1000атм.,Q = 69 кдж/моль
Для смещения равновесия вправо необходимо увеличивать давление и понижать температуру. Однако при низкой температуре очень мала скорость процесса.В производственных условиях для получения требуемой скорости синтез аммиака ведут при температуре 400-500 0 С с использованием твердого катали-затора. В промышленности в настоящее время получил распространение же-лезный катализатор содержащий оксиды алюминия, кальция и магния, кото-рые усиливают его действие. Этот катализатор показал высокую активность и стойкость к перегревам и вредным примесям. Однако серосодержащие соеди-нения отравляют катализатор необратимо. При содержании в катализаторе 0,1 % серы его активность падает на 50%, а при содержании 1 % серы происходит полное отравление катализатора. Кислородсодержащие соединения отравляют катализатор сильно, но обратимо.
Синтез аммиака типичный гетерогенный каталитический процесс.
Основные стадии процесса:
1.Диффузия азота и водорода из ядра потока к зерну катализатора и внутрь пор зерна
2.Активированная абсорбция азота и водорода на катализаторе.
3.Взаимодействие азота и водорода на поверхности катализатора, при этом азот принимает электрон от катализатора, а водород отдает электрон катализа-тору, в результате чего последовательно образуются следующие поверхност-ные химические соединения: имид-NH, амид- NH 2 , аммиак.
4. Десорбция аммиака и его диффузия в объем газовой фазы.
Лимитирующей является 2 стадия.
Факторы, влияющие на выход аммиака
На выход аммиака влияет: давление, температура, активность катализатора, объемная скорость. Установлено, что с ее увеличением увеличивается съем аммиака с одного кубометра катализатора. Однако при этом увеличивается объем непрореагировавшей азото-водородной смеси. Это увеличивает расход энергии на транспортирование газа – поэтому оптимальная скорость выбира-ется исходя из экономических соображений. Обычно она составляет 15000 ч -1 .
Промышленные способы синтеза аммиака.
В производстве аммиака используют давление 100-1000 атм. и в зависимости от давления различают системы низкого давления (100-150 атм.), среднего
(200-600 атм.) и высокого(600-1000 атм.). В основном используют системы среднего давления, так как при этом давлении удачно решаются вопросы вы-деления аммиака при достаточной скорости процесса. Особенностью синтеза аммиака является его невысокий выход - 14-20%
Азото-водородная смесь, выходящая из контактного аппарата подверга-ется охлаждению, аммиак при этом конденсируется и выделяется, а азото-водородная смесь возвращается в аппарат. Свежая азото-водородная смесь до-бавляется в необходимом количестве.
При рециркуляции происходит постепенное накопление примесей, что приводит к уменьшению активности катализатора и, как следствие, к умень-шению производительности. Частично примеси растворяются в аммиаке и вы-водятся из цикла. Однако вывод примесей с аммиаком не компенсирует при-ток примесей со свежей азото-водородной смесью. Поэтому периодически часть азото-водородной смеси приходится сбрасывать в атмосферу.
Устройство колонны синтеза
Конструкция колонны должна быть надежной и обеспечивать безопас-ную и длительную работу.
Азот и водород при повышенной температуре снижают прочность стали, особенно опасно обезуглероживание стали под действием водорода. Для уменьшения температуры стенок холодная азото-водородная смесь поступает в колонну вдоль внутренних стенок. Корпус изготовлен из хром-ванадиевой стали, толщина стенки составляет 175-200мм. Внутренний диаметр 1-2,8м, высота 12-20м. Сверху и снизу колонна закрывается стальными крышками, укре-пленными с помощью фланцев. Снаружи колонна имеет теплоизоляцию.
Технологическая схема получения аммиака
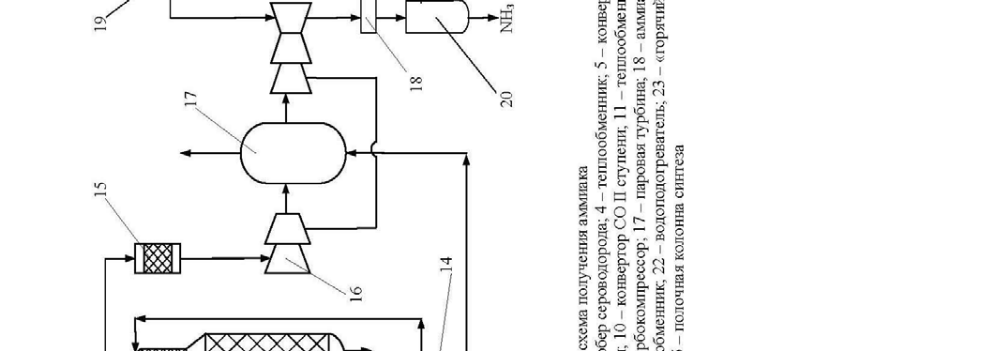
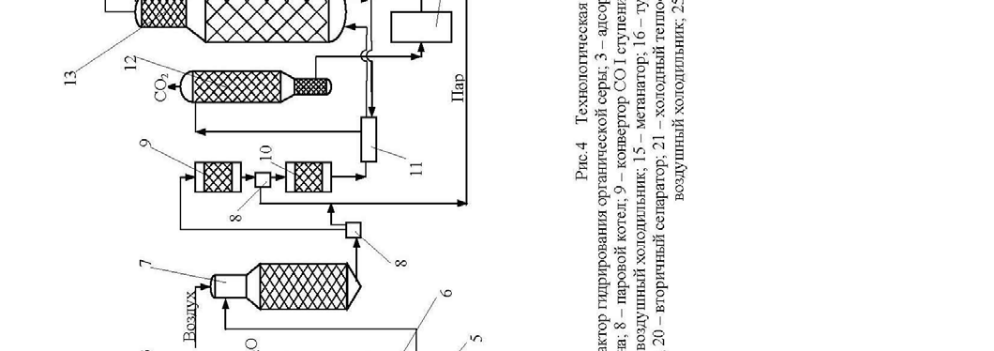
Технологическая схема получения аммиака представлена на рис.4. При-родный газ подогревается в подогревателе 1 отходящими газами и поступает в реактор гидрирования серусодержащих соединений, туда же подается водо-род. После гидрирования газ поступает в адсорбер 3, заполненный окисью цинка. На выходе из адсорбера газ смешивается с паром в соотношении 3,7:1, подогревается в теплообменнике 4 отходящими газами и поступает в трубча-тую печь 5 с топкой 6. В топке 6 сжигается природный газ. Процесс конверсии протекает на никелевом катализаторе при температуре 800-850 0 С. Содержание метана после первой стадии конверсии составляет 9-10%. Далее газ смешива-ется с воздухом и поступает в шахтный конвертер 7, где происходит конверсия остаточного метана кислородом воздуха при температуре 900-1000 0 С. Из шахтного конвертера газ поступает в котел-утилизатор 8, где получают пар высоких параметров (температура 480 0 С, давление – 100 атм.), направляемый в газовые турбины центробежных компрессоров 17. А газ из котла-утилизатора поступает на двухступенчатую конверсию CO:
1стадия идет в конверторе 9 на среднетемпературном железо-хромовом ката-лизаторе при температуре 430-470 0 С.
2 стадия происходит в конвертере 10 на низкотемпературном цинко-хромово-медном катализаторе при температуре 200-250 0 С. Между стадиями газ прохо-дит котел-утилизатор 8.
Затем газ поступает через теплообменник 11 на очистку от кислородсо-держащих соединений в скруббер 13, орошаемый холодным раствором моно-этаноламина, где при температуре 30-40 0 С происходит очистка газа от СО, СО 2 , и О 2 . На выходе из абсорбера газ содержит CO до 0,3% , CO 2 ≤ 0,003%. Газ поступает на гидрирование кислородсодержащих примесей в метанатор 15. Далее газ поступает в центробежный циркуляционный компрессор 16 с приводом от паровой турбины 17, где он сжимается до давления 300 атм.
Свежая азото-водородная смесь затем смешивается с циркулирующей смесью перед системой вторичной конденсации, которая состоит из аммиач-ного холодильника 18 , сепаратора 20, затем вся эта смесь проходит теплооб-менники 21 и 23 и направляется в колонну синтеза 25.
Прореагировавший газ проходит последовательно водоподогреватель 22, теплообменник 23, воздушный холодильник 24, теплообменник 21, поступает в сепаратор жидкого аммиака 19, затем поступает в компрессор 16, где смеши-вается со свежей азото-водородной смесью.
Сконденсировавшийся аммиак выводится из сепараторов 19 и 20.
Производство азотной кислоты
Азотная кислота – это одна из важнейших минеральных кислот, пред-ставляет из себя тяжелую бесцветную жидкость. С водой она смешивается в любых соотношениях с выделением тепла. Является сильным окислителем. Она взаимодействует со всеми металлами кроме металлов платиновой группы. При взаимодействии с азотной кислотой органические ткани разрушаются. Производится и используется разбавленная HNO 3 - 50-60% и концентрирован-ная - 96-98%.
Теоретические основы производства азотной кислоты
Процесс получения азотной кислоты из аммиака складывается из сле-дующих стадий:
1. Контактное окисление аммиака до NO
П. Окисление NO до NO 2
Ш. Абсорбция NO 2 водой


Наибольшее количество установок по производству серной кислоты использует в качестве сырья серу. Сера нижется побочным продуктом переработки природного газа и некоторых других промышленных газов (генераторного, газон нефтепереработки). Такие газы всегда содержат какое-то количество сернистых соединений. Сжигание неочищенного от серы природного газа приведет к загрязнению окружающей среды оксидами серы. Поэтому сернистые соединения обычно сначала удаляют и виде сероводорода, который затем частично сжигают до SO2, после чего смесь сероводорода и диоксида серы взаимодействует на слое боксита при 270-300 єС, превращаясь в результате этого взаимодействия в S и Н2O. Полученная таким образом сера называется «газовой». Кроме «газовой», в качестве сырья может использоваться самородная сера.
Сера как сырье для производства серной кислоты имеет ряд преимуществ. Во-первых, она в отличие от серного колчедана, почти не содержит примесей, которые могли бы представлять собой каталитические яды на стадии контактного окисления диоксида серы, например, соединений мышьяка. Во-вторых, при ее сжигании не образуется твердых и иных отходов, которые требовали бы складирования или поиска методов их дальнейшей переработки (при обжиге колчедана на 1 т исходного колчедана образуется практически столько же твердого отхода -- огарка). В-третьих, серу значительно дешевле транспортировать, чем колчедан, так как это концентрированное сырье.
Рассмотрим "короткую» схему получения серной кислоты из серы методом ДКДА (рис. 2).
Рис. 2. Схема производства серной кислоты из серы по методу двойного контактирования и двойной абсорбции:
1 -- печь для сжигания серы; 2 -- котел-утилизатор; 3 --экономайзер 4 -- пусковая топка: 5. 6 -- теплообменники пусковой топки. 7 -- контактный аппарат: 8 -- теплообменники 9 -- сушильная башня. 10, 11 -- первый и второй моногидратные абсорберы. 12 -- сборники кислоты: 13 -- выхлопная труба.
Расплавленную серу пропускают через сетчатые фильтры для очистки от возможных механических примесей (сера плавится при температуре. немногим выше 100 єС, поэтому такой способ ее очистки наиболее простой) и направляют в печь 1, в которую в качестве окислителя подают воздух, предварительно осушенный продукционной серной кислотой в сушильной башне 9. Выходящий из печи обжиговый газ охлаждают в котле-утилизаторе 2 с 1100-1200 єС до 440-450 єС и направляют с этой температурой, равной температуре зажигания промышленных катализаторов на основе пентоксида ванадия, на первый слой полочно-контактного аппарата 7.
Температурный режим, необходимый для приближения рабочей линии процесса к линии оптимальных температур, регулируется пропусканием потоков частично вступившего в реакцию обжигового газа через теплообменники 8, где происходит его охлаждение нагреваемыми потоками газа после абсорбции (или осушенного воздуха). После третьей ступени контактирования обжиговый газ охлаждают в теплообменниках 8 и направляют в промежуточный моногидратный абсорбер 10, орошаемый циркулирующей через сборник кислоты 12 серной кислотой с концентрацией, близкой к 98,3%. После извлечения в абсорбере 10 триоксида серы и достигнутого вследствие этого отклонения от почти достигнутого равновесия газ вновь нагревают до температуры зажигания в теплообменниках 8 и направляют на четвертую ступень контактирования.
В данной схеме для охлаждения газа после четвертой ступени и дополнительного смешения равновесия к нему добавляют часть осушенного воздуха. Прореагировавшие в контактом аппарате газы пропускают для охлаждения через экономайзер 3 и направляют в заключительный 11 моногидратный абсорбер 11, из которого не содержащие оксидов серы газы выбрасывают через выхлопную трубу 13 в атмосферу.
Для пуска установки (вывода ее на заданный технологический, в частности температурный, режим) предусмотрены пусковая топка 4 и теплообменники пусковой топки 5 и 6. Эти аппараты отключаются после вывода установки в рабочий режим.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и ее свойст-вами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из сильных кислот, в широком диапазоне температур
(- 40… - 20 260 - 336,5С) находится в жидком состоянии.
Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой с выделением большого количества теплоты. Плотность H2SO4 при 0С равна 1,85 г/см3, а температура кристаллизации 10,7С.
Крупнейшими потребителями серной кислоты являются производства минераль-ных удобрений: суперфосфата, сульфата аммония.
Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и др.) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тка-ней), лаков и красок (для зданий и машин) лекарственных веществ и некоторых пластмасс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд ядохимикатов для борьбы с вре-дителями сельского хозяйства и сорными травами.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В элек-тротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту при-меняют как компонент реакционной среды в процессах нитрования, в частности, при по-лучении взрывчатых веществ.
При нитровании, в производстве этилового спирта из этилена, при концентрирова-нии азотной кислоты и в других процессах применяют серную кислоту концентрацией от 92 до 98%, а выводят из процесса разбавленную 50 - 80%-ную кислоту. Чтобы возвратить ее в новый цикл, полученные водные растворы упаривают.
Сырьевая база производства серной кислоты - серосодержащие соединения, из ко-торых можно получить диоксид серы. В промышленности около 80% серной кислоты по-лучают из природной серы и железного (серного) колчедана. Значительное место в сырье-вом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепере-работке. Первый обжиг серосодержащего сырья для получения диоксида серы.
Производство серной кислоты включает в себя следующую последовательность стадий:
Обжиг серного колчедана или серы.
Окисление диоксида серы.
Абсорбция триоксида серы.
Исходные вещества - минеральное сырье - содержит примеси, поэтому выходящие со стадии обжига газы подвергаются очистке. Первая стадия - обжиг, специфичен для ка-ждого вида сырья, и далее она будет рассматриваться для колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления и абсорбции в основном одина-ковы в разных способах получения серной кислоты. Поэтому эти стадии будут рассмотре-ны как типовые процессы.
Обжиг серосодержащего сырья.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает в себя ряд последовательно или параллельно протекающих реакций:
Термическая диссоциация
Газофазное горение серы
Горение пирротина
Или суммарно:
При небольшом избытке или недостатке кислорода образуется смешанный оксид железа
Температура. Термическое разложение пирита начинается уже при температурах около 200С и одновременно воспламеняется сера. При температурах выше 680С интен-сивно протекают все три реакции.
В промышленности обжиг ведут при 850 - 900С, когда общая скорость процесса лимитируется массопереносом окислителя (кислорода) к поверхности пирита и продуктов разложения в газовую фазу. В общем виде движущая сила этого процесса может быть вы-ражена уравнением
(1)
Из этого уравнения видно, что факторами увеличения производительности процесса яв-ляются интенсификация массопереноса (), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть увеличен повышением температуры, поверхность контакта фаз существенно возрастает с увеличением степени дисперсности твердого материала, а высокие концентрации реагентов обеспечиваются ис-пользованием обогащенного пирита и увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду, что чрезмерное повышение температуры способствует раз-мягчению и слипанию частиц твердого сырья, а применение концентрированных реаген-тов удорожает их стоимость и приводит к чрезмерному росту температуры в условиях ав-тотермического режима. Это обусловливает выбор оптимальной температуры, сочетаю-щей достаточную производительность процесса и использование сырья с соответствую-щим содержанием активных компонентов при минимуме процессов агломерации твердого материала. На практике процесс проводят при температуре 850 - 900С.
Давление. В соответствии с уравнением (1) давление является фактором скорости процесса, однако его рост может привести в условиях автотермического режима к чрез-мерному увеличению температуры и слипанию частиц твердого материала. Кроме того, увеличение давления приводит к увеличению расходов на компремирование. Поскольку реакция обжига в условиях указанных температур протекает достаточно гладко, то пред-почитают работать при атмосферном давлении.
Соотношение воздух-колчедан поддерживается на уровне, обеспечивающем избы-ток кислорода по сравнению с его стехиометрическим количеством, с целью достижения высоких степеней обжига, однако этот избыток не должен быть чрезмерным, т.к. при зна-чительных избытках рост степени извлечения серы из колчедана перекрывается значи-тельным разбавлением газов обжига и понижением концентрации SO2 в них, что отрица-тельно влияет на последующий процесс окисления SO2 в SO3.
Ранее доминирующим типом реактора был многополочный реактор, снабженный скребками для выравнивания слоя на каждой полке и организации транспорта твердой фа-зы с верхних полок на нижние (см. типы реакторов для гетерогенных реакций с участием твердой фазы).
В таком реакторе степень дисперсности колчедана невелика, что существенно ог-раничивает производительность реактора. Кроме того, в таком реакторе движущиеся скребки в высокотемпературной зоне усложняют его конструкцию, создается неоднород-ный температурный режим по полкам, в нем трудно организовать отвод тепла из зоны ре-акции. Трудности теплосъема не позволяют получить обжиговый газ с концентрацией SO2 более 8 - 9%. Основное ограничение - невозможность использования мелких частиц, в то время как для гетерогенного процесса основной способ ускорения реакции - дробление частиц. По этой причине более перспективными являются аппараты к «кипящем слоем» твердых частиц. Их степень дисперсности позволяет на порядок ускорить процесс.
Пылевидный колчедан подается через питатель в реактор. Окислитель (воздух) по-дается снизу через распределительную решетку со скоростью, достаточной для взвешива-ния твердых частиц. Их витание в слое предотвращает слипание и способствует хорошему контакту с газом, выравнивает температурный режим по всему слою, обеспечивает под-вижность твердого материала и его переток в выходной патрубок для вывода огарка из реактора. В слое подвижных частиц можно расположить теплообменные элементы. Бла-годаря увеличению глубины обжига содержание SO2 в обжиговом газе увеличивается до 13 - 15%. Основной недостаток печей кипящего слоя - повышенная запыленность обжи-гового газа из-за механической эрозии подвижных твердых частиц. Это требует более тщательной очистки газа от пыли в циклоне и электрофильтре.
Сжигание серы.
Сера - легкоплавкое вещество: температура ее плавления 113С. Перед сжиганием ее расплавляют, используя пар, полученный при утилизации тепла ее сжигания. Расплав-ленная сера отстаивается и фильтруется для удаления имеющихся в природной сере при-месей и насосом подается в печь сжигания. Сера горит в основном в парофазном состоя-нии. Чтобы обеспечить ее быстрое испарение, необходимо ее диспергировать в потоке воздух. Для этого используют форсуночные и циклонные печи. Первые оборудованы го-ризонтальными форсунками для тонкого распыления жидкости. В циклонной печи жидкая сера и воздух подаются тангенциально и за счет вихревого движения достигается диспер-гирование жидкости и перемешивание двух потоков. Мелкие капли быстро испаряются и сера в парообразном состоянии сгорает. Горение протекает адиабатически, и температура зависит от концентрации образующегося SO2.
За счет высокой теплоты сгорания серы температура в печи составляет более 1000С. Этих условий достаточно для испарения жидкой серы. Печь сжигания работает в комплексе с вспомогательным оборудованием для плавления и фильтрования серы и кот-лом-утилизатором для использования тепла реакции.
Газы обжига колчедана содержат в виде примесей соединения фосфора, селена, теллура, мышьяка и некоторые другие, образующиеся из примесей сырья. Естественная влага сырья также переходит в газ. При горении образуются некоторое количество SO3 и возможно оксиды азота. Эти примеси приводят или к коррозии аппаратуры или к отравле-нию катализатора, а также ухудшают качество серной кислоты. Их удаляют в промывном отделении. Согласно схеме газ последовательно проходит две промывные башни, оро-шаемые растворами серной кислоты (60 и 20%-ой). В первой башне обжиговый газ охла-ждается с 300 - 500С до 60 - 70С и освобождается от остатков пыли и части примесей. Эта башня полая. Обеспыленный газ отмывается 15 - 20%-ой серной кислотой от соеди-нений As, Fe, Se во второй башне с насадкой. Окончательная осушка от влаги осуществля-ется в 3 - 9 башнях (сушильной), орошаемых концентрированной серной кислотой.
Окисление диоксида серы.
Реакция
Является обратимой и экзотермической и протекает с уменьшением объема. Она осущест-вляется на катализаторах, основой которых является V2O5 с добавлением оксидов щелоч-ных металлов, нанесенных на оксид кремния.
Обоснование роли параметров и их выбор.
Температура проходит максимум производительности, характерный для обрати-мых экзотермических реакций. Следует иметь в виду, что чрезмерное увеличение темпе-ратуры может привести к диффузионному торможению процесса и это может повлиять на положение экстремума производительности и его величину.
В значительной степени выбор температуры определяется верхним и нижним пре-делом этого параметра. При Т<400 0C активность катализаторов весьма мала, а выше 600 0С происходит их термическая дезактивация. Оптимальными являются температуры, ле-жащие внутри этих пределов.
Давление является фактором скорости процесса и фактором смещения равновесия, однако на практике исходя из соображений экономии энергозатрат, а также благодаря возможности достичь высокой производите и степени превращения за счет использования других факторов предпочитают работать при давлениях, близких к атмосферному. Неко-торое избыточное давление необходимо для преодоления гидравлических сопротивлений установки при организации транспортных потоков реагентов.
Соотношение O2:SO2. является фактором смещения равновесия, а также фактором скорости процесса в соответствии с уравнением Борескова
(2)
Однако сверху это соотношение ограничивается замедлением роста скорости при высоких и значительным снижением содержания SO2 в контактных газах, поступаю-щих на абсорбцию, что снижает эффективность последней. На практике используют из-быток О2 более чем полтора по отношению к стехиометрическому.
Время контакта выбирается, исходя из максимально достижимой конверсии. Пре-делом такой конверсии является максимальная степень превращения, при которой ско-рость процесса близка к нулю. Поэтому за время реакции выбирается то минимальное время, при котором степень конверсии практически близка равновесной. Обычно эта ве-личина равна 90-95 %, а соответствующее ей время - несколько секунд.
Технология контактного окисления SO2.
Чаще всего в промышленности используют полочные аппараты со съемом тепла реакции между полками. Схема теплообменника предполагает максимальное использова-ние тепла реакции для подогрева исходного газа. При этом съем тепла между полками осуществляют в той мере, которая позволяет приближать рабочую температуру к опти-мальному значению этого параметра.
Одна из важнейших задач производства серной кислоты состоит в увеличении сте-пени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача мо-жет быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи - метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакци-онную смесь, в которой степень превращения SO2 составляет 90 - 95%, охлаждают и на-правляют в промежуточный абсорбер для выделения SO3; в оставшемся реакционном газе соотношение O2: SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ опять подают в контактный аппарат, где на достигается 95% степень превращения оставшегося SO2. Суммарная степень пре-вращения SO2 в таком процессе достигает 99,5 - 99,8%.
Абсорбция триоксида серы.
Абсорбция триоксида серы - последняя стадия процесса на которой образуется серная кислота. Взаимодействие SO3 с водой
Протекает достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять в себе SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы серной кислоты чрезвычайно агрессивны.
Равновесие «газ-жидкость» для «H2O-H2SO4-SO3» представлено на рисунке 1. Осо-бенностью этой системы является то, что в широком интервале концентраций раствора серной кислоты в паровой фазе присутствуют чистые пары воды, а над олеумом - в газовой фазе преобладает SO3. Одинаковый состав жидкой и паровой фаз (азеотропная точка) будет при концентрации серной кислоты 98,3%. Если SO3 поглощать раствором с меньшей концентрацией, то реакция (3) будет протекать и в паровой фазе - будет образовываться туман серной кислоты, который уйдет из абсорбера с газовой фазой. А это - и потери продукта, и коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсор-бировать олеумом, то поглощение будет неполным.
Из этих двух свойств следует двухстадийная схема абсорбции (рисунок 2). Газ, со-держащий SO3 после реактора проходит последовательно олеумый (1) и моногидратный (2) абсорберы. Другой компонент реакции (H2O) подается противотоком через сборник в моногидратный абсорбер. За счет интенсивной циркуляции жидкости (абсорбата) в ней можно поддерживать близкую к оптимальной концентрацию H2SO4 - 98,3% (увеличение концентрации за проход жидкости не более 1 - 1,5%). Концентрационные условия аб-сорбции обеспечиваю полное поглощение SO3 и минимальное образование сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20% раствор Н2SO4, который частично отбирается как конечный продукт - олеум. Ки-слота из предыдущего абсорбера - моногидрат - также может быть продуктом. В системе циркуляции предусмотрены холодильники для съема тепла реакции и обеспечения более эффективной абсорбции. При температурах меньше 100С SO3 поглощается практически полностью, диоксид серы - практически не поглощается.
Перспективы развития сернокислотных производств.
Мощным средством повышения производительности сернокислотных производств является увеличение концентрации диоксида серы. Высококонцентрированные газы, со-держащие до 80% SO2 уже начали получать в производствах цветных металлов из их сульфидных руд с применением технического кислорода.
Получение высококонцентрированного сернистого газа позволяет создать энерго-технологические циклические производства серной кислоты из серы и колчедана. Диок-сид серы полученный с применением технического кислорода окисляют на 90% в кон-тактном аппарате с «кипящем слоем» катализатора. При абсорбции SO3 получают высо-коконцентрированный олеум и моногидрат. Газ после абсорбции возвращают на контак-тирование. В реакторе общая степень превращения составляет 99,995%. Для отвода нака-пливающегося в результате многократного рецикла азота часть газа после абсорбции про-пускают через малогабаритную сернокислотную установку, из которой азот выбрасывает-ся в атмосферу. Интенсивность работы циклической системы, работающей под давлением около 1 МПа, с применением кислорода в десятки раз превышает интенсивность обычных систем. Потери серы с отходящими газами и соответственно выбросы SO2 и SO3 в окру-жающую среду также снижены в десятки раз.
Схемы предусматривают генерирование водяного пара (4 МПа) за счет тепла газов обжига, который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода. Тепло сернистых газов после прохождения очередного каталитического слоя можно использовать для пред-варительного подогрева реагентов на входе в контактный аппарат. Тепло сорбции исполь-зуется для бытовых нужд.
Важнейшими направлениями развития производства серной кислоты являются:
1. Увеличение мощности аппаратуры при одновременной комплексной авто-матизации производства.
2. Интенсификация процессов путем применения реакторов «кипящего слоя» (как на стадии обжига, так и при контактном окислении SO2), более актив-ных катализаторов, повышенных давлений и использование технического кислорода в процессе окисления.
3. Разработка энерготехнологических схем с максимальным использованием теплоты экзотермических реакций, в том числе циклических систем под давлением.
4. Увеличение степеней превращения на всех стадиях производства для сни-жения расходных коэффициентов по сырью и материалам и снижение вред-ных выбросов.
5. Утилизация вредных выбросов из отходящих газов, а также твердых отхо-дов (огарок). Например, нежелательные вредные примеси H2S и SO2 из раз-ных потоков можно объединить и подвергнуть концентрированию с целью перевода их в элементарную серу.
Твердый огарок, содержащий оксид железа можно использовать в качестве сорбента для улавливания газов и очистки сточных вод.
