Химия подготовка к ЗНО и ДПА
Комплексное издание
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЯ ЭЛЕМЕНТОВ
ОКСИГЕН. СУЛЬФУР
Сероводород
Молекула сероводорода состоит из атома Серы и двух атомов Водорода, соединенных полярным ковалентной связью. Угол между связями
SH равна 91°. Молекула сероводорода полярная.Сероводород - природный компонент вулканических и природных газов. Некоторые минеральные воды содержащие растворенный сероводород, что придает им лечебных свойств. Сероводород образуется в результате гниения продуктов, содержащих в своем составе белки. В Черном море на глубине более 40 метров нет жизни через насыщенность вод сероводородом.
Физические свойства сероводорода
Сероводород - бесцветный газ с запахом тухлых яиц. В 1 объеме воды растворяется 3 объема сероводорода, при этом образуется примерно 0,1 молярный раствор. Температура плавления сероводорода равна -83 °С, а температура кипения -61 °С. Сероводород влияет на нервную систему человека, поэтому работать с ним необходимо под вытяжной шкафом.
Химические свойства сероводорода
Сероводород является соединением, имеет строение, подобное молекулы воды, однако по сравнению с ней есть менее стабильной. В случае нагрева до высоких температур происходит разложение сероводорода по реакции:
Горения может происходить по двум различным направлениям. В избытке кислорода образуется вода и сульфур(И
V ) оксид:По недостатке кислорода происходит неполное сгорание сероводорода. Этот процесс используется для добывания серы в промышленных масштабах из газов, которые образуются во время обжига руд:
Бром и йод восстанавливают сероводород до простого вещества серы:
Сероводород при повышенных температурах реагирует с гексафторсульфуром:
В случае растворения сероводорода в воде образуется слабая двохосновна сульфидная кислота (К a 1 = 10 - 7 , К a 2 = 1,2 ∙ 10 - 13 ):
![]()
Средние соли сульфидной кислоты называются сульфидами (например, K 2 S - это калий сульфид). Известны также кислые соли соответствующей кислоты - гідрогенсульфіди (KHS - калий гідрогенсульфід). Поскольку сульфидная кислота является довольно слабой кислотой, то растворы сульфидов и гідрогенсульфідів подвергаются гидролизу по аниону, и соответственно среда раствора основное:
Сульфиды щелочных и щелочноземельных металлов растворимы в воде, а другие сульфиды не растворимы. Много солей сульфидной кислоты имеют характерную окраску: HgS - красное, Sb 2 S 3 - оранжевое, CdS - желтое, MnS - розовое, CuS - черное.
Добывания и применения сероводорода
Сероводород обычно добывают действием минеральных кислот на сульфиды металлов:
Сероводород также можно добыть и из простых веществ.
Применяют сероводород в качественном анализе катионов по сульфідною классификации. Также он играет важную роль в процессе производства серной кислоты.
Качественная реакция на сероводород i сульфид-ион
Для определение сульфид-ионов в растворе к исследуемому раствору добавляют любую растворимую соль Свинца (чаще всего ацетат Р b (СН 3 СОО) 2 или нитрат Pb (NO 3 ) 2). Если после добавление в растворе появляется черный осадок, то в исследуемом образце присутствовали сульфид-ионы:
Если о говорят, что он слаб, значит, пришла болезнь, или голод, в общем, невзгоды. В химии все иначе. Рассмотрим слабую сероводородную . Слаба она не потому, что готова распасться, погибнуть а, напротив, из-за нежелания диссоциировать.
Так именуют процесс растворения в воде, разделения на ион гидроксония и анион . Сероводородная диссоциирует всего на 0,011%, причем, в две стадии. На первой из них степень распада не превышает 0,005%.
Так что, является вполне стойкой, «держит удар». Однако, это по человеческим меркам. В химии все иначе. Погрузимся в ее мир, продолжив изучение свойств сероводородной .
Свойства сероводородной кислоты
Стойкость героини относительна. Не желая до конца растворяться в воде, соединение распадается под действием кислорода. Он окисляет сероводородную кислоту. Формула ее выглядит так: — Н 2 S. Н в ней – , S – . Так вот, последний при окислении «вырывается» из формулы. Соединение распадается.
По сути, сероводородная кислота является водным раствором газа. Сероводород известен запахом тухлых яиц и ядовитостью. у вещества нет. Нет и у индикаторных бумажек, побывавших в сероводородной кислоте. Свойство это – еще один указатель на слабость соединения. Сильные окрашивают лакмус в тона.
Характеристика сероводородной кислоты сводится не только к медленному растворению в воде. Прочие реакции с героиней статьи тоже проходят неторопливо. Применительно к человеческому характеру, это, скорее, лень, чем слабость.
С металлами, к примеру, сероводородный раствор реагирует нехотя. Объяснение тому – малая концентрация положительных ионов водорода. Их дефицит связан с малой степенью диссоциации .
Из металлов героиня статьи взаимодействует лишь с теми, которые в ряду напряжения стоят до Н 2 . Такие элементы способны вытеснять водород из раствора. Взаимодействие может привести к образованию соли сероводородной кислоты .
Она полностью нерастворима в воде. Реплика касается сульфидов. Это один из типов , образуемых при участии сероводородного соединения. Второй тип – гидросульфиды. Они образуются в ходе реакции с щелочными и щелочноземельными , растворимы.
Вступая во взаимодействие со щелочноземельными металлами, сероводородная реагирует и со щелочами. Героиня статьи выступает восстановителем, то есть, отдает электроны. Получается, свойства соединения типичны для слабого типа.
Неоднозначно другое. Являясь раствором ядовитого сероводорода, героиня статьи опасна лишь относительно. За счет малой концентрации исходного вещества, становится лекарством. Где и как его применяют, расскажем в следующей главе.
Применение сероводородной кислоты
Диссоциация сероводородной кислоты до раствора насыщенностью в тысячные процента позволяет использовать соединение для лечебных . Их, как правило, организуют на местах выхода подземных вод, содержащих сероводород. Запах тухлых яиц терпят ради избавления от кожных недугов, реабилитации системы, лечения бессонницы.
Ванны с сероводородной улучшают кровоток, а значит, благотворно влияют на весь организм. Быстрее передвигаясь по сосудам, кровь не застаивается, оперативнее снабжает органы необходимыми им элементами. Ускоряется обмен веществ, приводя к очищению от шлаков. На общий эффект омоложения.
«На лицо» употреблено в прямом значении. Косметологи применяют раствор сероводорода для лифтинг-процедур. Кроме подтяжки , можно избавиться от целлюлита и угревой сыпи. Локальное нанесение раствора имеет меньше противопоказаний, чем ванны.
Медики замечают, что ванны с сероводородом не принимают в домашних условиях и, вообще, закрытых помещениях. Концентрация паров, исходящих от воды, может превысить допустимые .
В санаториях бассейны стараются расположить под открытым небом. Источники горячие. Поэтому, купаться в них приятно даже зимой. Ряд сероводородных курортов есть, к примеру, вблизи города Северобайкальск.
Врачи, курирующие постояльцев, рекомендуют героиню статьи еще и в качестве лекарства от недугов мочеполовой системы. Правда, беременным и кормящим процедуры противопоказаны. Зато, тем, кто хочет стать родителем, ванны с сероводородом не повредят.
На западе страны сероводород образуется вдоль шельфа Черного моря. Правда, там соединение образуется на глубине около 150-ти метров, выходя пузырьками на мелководье.
Если временные процедуры в атмосфере газа приемлемы, то длительное вдыхание сероводорода ведет к угасанию способности чувствовать запахи. Это итог паралича обонятельного нерва.
Как распознать сероводородную кислоту в воздухе при малой концентрации, в отсутствии явного запаха? Поможет лишь . Она тоже ядовита, но, иначе никак. В реактиве смачивают . В атмосфере с содержанием сероводорода хотя бы в 0,0000001% лист покроется налетом.
Получение сероводородной кислоты
Раз является раствором сероводорода, стоит задаться вопросом его получения. Популярен способ использования и сульфида . В качестве последнего берут природные минералы. Сульфидов в недрах планеты несколько. Самый известный, пожалуй, . Его формула: — FeS 2 .
Реакция между сульфидом и бурная, с активным выделением газа. Соответственно, взаимодействие проводят в изолированных помещениях, используя защитные и одежды.
Промышленники чаще идут другим путем. Сероводород – побочный продукт многих производств. Остается лишь вытянуть вещество из промышленных газов, очистка которых, все равно, прямая обязанность предприятий.
Потом, сероводород растворяют в воде. Жидкость нагревают. Так диссоциация проходит успешнее. Героиня статьи готова к использованию, или продаже. Узнаем ценники.
Цена сероводородной кислоты
Поскольку в быту героиня статьи нужна лишь для водных процедур, форма продажи соединения сводится к для сероводородных ванн. Пример: — средство «Мацеста». Продается в аптеках, как и прочие препараты группы.

«Мацеста» реализуется в пакетах, добавляется в ванну с водой температурой в 37-38 градусов Цельсия. Препарат тщательно размешивают и погружаются на 5-15 минут. Стоит удовольствие около 300-от за пакет, то есть, одну процедуру.
Замечание об опасности принятия сероводородных ванн в домашних условиях никто не отменял. Но, производители перестраховываются, подбирая оптимальную, безопасную концентрацию. При ней, за 15 минут не нанести.
Для лабораторных нужд и промышленных производств нет смысла платить за воду с минимальной долей сероводорода. Удобнее организовать поставки сжиженного газа в баллонах и самим сделать . Товар специфический, спрос ограничен. Поэтому, предложений немного, а на баллоны с газом, как правило, договорная.
РАЗДЕЛ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
9. Неметаллические элементы и их соединения. Неметаллы
9.3. Элементы VIA группы
9.3.7. Сероводород (сульфид водорода). Сероводородная (сульфидная) кислота. Сульфиды 2
Сероводород и сероводородная кислота Сероводород или сульфид водорода H 2 S ,- летучее соединение Серы с Гідрогеном. В молекуле сероводорода атом Серы образует две ковалентные полярные связи с двумя атомами Водорода. Валентный угол составляет 92,1°. Раствор H 2 S в воде называют сероводородной кислотой.
Распространенность сероводорода в природе
В природе сероводород встречается в составе природных и вулканических газов, содержится в воде некоторых минеральных источников, также образуется при разложении органических веществ (растительных и животных остатков), а потому в небольшом количестве содержится в воздухе.
Огромные запасы сероводорода накопленные в глубинах Черного моря: его слой начинается с глубины 150-200 м и достигает дна (максимальная глубина - 2210 м). Концентрация сероводорода на глубине 150 м - 0,19 мг/л морской воды, на глубине 200 м - 0,83 мг/л, а на глубине 2000 м достигает 9,60 мг/л. Таким образом, за исключением некоторых специфических микроорганизмов, там почти нет живых существ.
Физические свойства и физиологическое действие сероводорода
Сероводород - бесцветный газ с резким неприятным запахом тухлых яиц - вич воды растворяется до 2,5 л H 2 S . Сероводород очень ядовит. Наличие в воздухе объемной доли 0,1 % вызывает отравление. Гидроген сульфид связывает гемоглобин, образуя с ионом Fe 2+ , входящей в его состав, малорозчинну соединение - феррум(II) сульфид.
Добыча сероводорода
В лаборатории для извлечения сероводорода используют реакцию между сульфидом металлического элемента и хлоридной кислотой или разбавленной серной кислотой:
В промышленности сероводород добывают, пропуская водород над расплавленной серой:
![]()
Химические свойства сероводорода и сульфидной кислоты
Сероводород
1. Сероводород горит голубоватым пламенем:
При недостатке кислорода образуется сера:
2. Сероводород относят к сильным восстановителям - он может окисляться до серы, сульфур(И V ) оксида или серной кислоты:
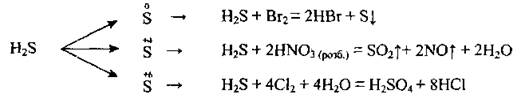
3. Сульфид водорода взаимодействует с кислотами-окислителями:

4. Реагирует и с сильными, и со слабыми окислителями:
Использование сероводорода
1. В химической промышленности для получения серной кислоты, элементарной серы, сульфидов.
2. В органическом синтезе серосодержащих веществ (тиолов 3 ).
3. Как реагент в аналитической химии для обнаружения ионов тяжелых металлических элементов (Ag + , Pb 2+ , С u 2+ ).
4. В перспективе возможно использование гигантских запасов сероводорода, которые содержатся в Черном море для нужд сероводородной энергетики и химической промышленности.
5. В медицине природные источники и искусственные ванны, содержащие сероводород, используют для борьбы с кожными заболеваниями.
Сульфидная кислота
Раствор сероводорода в воде - сероводородная вода, или сероводородная (сульфидная) кислота - слабая двохосновна кислота. Она слабее сульфітну кислоту H 2 SO 3 . Диссоциирует двоступенево (за II степенью - в незначительной степени):
![]()
Сульфидная кислота проявляет общие свойства кислот. Она реагирует с основными оксидами, основаниями, образуя средние и кислые соли, а также с некоторыми солями и металлами:

Соли сероводородной кислоты
Сероводородная кислота образует два ряда солей: средние - сульфиды (K 2 S , CaS ) - и кислые - гідроґенсульфіди (KHS , Ca (HS ) 2). Растворимыми в воде сульфиды щелочных и щелочноземельных металлических элементов, а также аммоний сульфид (NH 4 ) 2 S . Некоторые сульфиды имеют характерную окраску: черное - PbS и CuS , желтое - CdS , белое - ZnS , MgS , розовое - MnS .
Химические свойства сульфидов
1. Растворимые в воде сульфиды медленно гидролизуют, то есть разлагаются водой:
В результате полного гидролиза в растворе некоторые сульфиды получить невозможно:
2. Сульфиды реагируют с некоторыми другими солями:

Эти две реакции являются качественными на обнаружение сульфид-иона S 2- , ведь наблюдается образование характерных осадков черного цвета - CuS и PbS .
3. Сульфиды разлагаются сильными кислотами:
4. Сульфиды при взаимодействии с окислителями проявляют восстановительные свойства:
______________________________________________________________
1 Реакцию используют для связывания разлитой ртути (демеркуризация). Участок пола, где разбился ртутный термометр, необходимо посыпать порошком серы. Киноварь - неядовитая соединение. Она не испаряется (при комнатной температуре) и легко может быть собрана.
2 Полисульфиды - соединения Серы с общей формулой X 2 S n , структура которых содержит цепочки атомов - S - S ( n -2) - S -, где, в зависимости от компонента X, n может варьироваться: в полісульфідах Водорода H 2 S n (оліїсті жидкости в зависимости от содержания Серы от желтого до красного цвета) п изменяется от 2 до 23, в полісульфідах аммония (NH 4 ) 2 S n - от 2 до 9, щелочных металлов Me 2 S n - от 2 до 8. Их используют в кожевенной промышленности для удаления волос с кожи), в производстве красителей, полисульфидных каучуков, в аналитической химии.
3 Тіоли (или меркаптаны) имеют сильный неприятный запах. В частности, егантіол C 2 H 5 SH добавляют к природному газу (метану запаха нет) перед его подачей в бытовой газопровод, чтобы обнаружить утечки газа из системы.
