Это определение оставляет в стороне элементы VIII группы главной подгруппы - инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом . Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрнцательности. Оиа изменяется в пределах от 2 до 4. Неметаллы - это элементы главных подгрупп, преимущественно р элементы, исключение составляет водород - s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов , имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах - соединениях с металлами, подобных соединениям металлов с галогенами - галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 - газ. Его молекула, подобно галогенам , двухатомна.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах (рис. 47).
Фтор - самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего 161 Совсем немного, если учесть, что известно 114 элементов. Два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере всодержнтся 0,03% от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. Шесть неметаллов - С, Н, О, N, Р и S - биогенные элементы, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элемента ми-неметаллами (кислород О2, азот, углекислый газ СО2, водяные пары Н2О и др.).
Водород - главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88%. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 - атомы водорода.
Простые вещества-неметаллы. Строение. Физические свойства
В простых веществах атомы неметаллов связаны кова-лентнон неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Ки, Вг2), двойные (например, в молекулах серы тронные (например, в молекулах азота ковалентные связи.
Как вам уже известно, простые вещества-неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы или твердые вещества и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ко-валентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала. (На рисунке 47 подчеркнуты символы тех элементов-неметаллов, которые образуют только атомные кристаллические решетки.)
Многие элементы-неметаллы образуют несколько простых веществ - аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул, и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен (рис. 48).
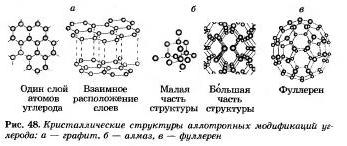
Элементы-неметаллы, обладающие свойством аллотропии, обозначены на рисунке 47 звездочкой. Так что простых веществ-неметаллов гораздо больше, чем химических элементов- неметаллов.
Вы знаете, что дли большинства металлов, за редким исключением (золото , медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ-неметаллов гамма цветов значительно разнообразнее.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы - диэлектрики, так как все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая дефор-мация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Химические свойства
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ неметаллов
1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами (как вы знаете, металлы всегда восстановители):

Окислительные свойства хлора Сl2 выражены сильнее, чем у серы, поэтому и металл Ре, который имеет в соединениях устойчивые степени окислеиия +2 b +3. окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения.
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение элек-троотрицател ьности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства.
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами. Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами -неорганическими и органическими.
Сильный окислитель хлор Сl2 окисляет хлорид железа (II) в хлорид железа(III).
Вы помните, конечно, качественную реакцию на непредельные соединении - обесцвечивание бромной воды.
Восстановительные свойства простых веществ - неметаллов
При рассмотрении реакции неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности одни из них проявляет свойства окислителя, а другой - свойства восстановителя.
1. По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служит восстановителями при взаимодействии с кислородом:

8 Многие неметеллы могут выступать в роли восстановителя в реакциях со сложными веществами окислителями:

Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, в восстановителем, это реакции самоокисления-самовосстановления.
Итак, подведем итоги! Большинство неметаллов могут выступал в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи одному только фтору).
Водородные соединения неметаллов
Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве которых неметалл имеет низшую степень окисления .
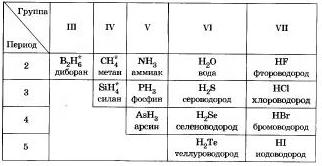
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметаллв е водородом, то есть синтезом.
Вм водородные соединении неметаллов обдоэоьаны коналентны-ми полярными свялямн, имеют молекулярное строение и при обычных условиях является газами, кроме воды (жидкость). Лла водородных соединений неметаллов характерно рвалнчное отношение к воде. Метай и енлан в ней практмческя нерастворимы. Аммиак при расстворении в воде образует слябое основание - гидрат аммиака.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителен, ведь в них неметалл имеет низшую степень окисления.
Оксиды неметаллов и соответствующие им гидроксиды
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные, жидкие (летучие), твердые (летучие).
Оксиды неметаллов делят на две группы: несолеобразующие и голеобразующие. При растворении кислотных оксидов в воде образуются гидраты оксидов - гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Оксиды и соответствующие им гидроксиды - кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, то есть высшее ее значение, называют высшими. При рассмотрении Периодического закона мы уже характеризовали их состав и свойства.
усиление кислотных свойств оксидов и шдронепдоп В пределах одной главной подгруппы, например, VI группы действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени оксиления неметалла.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут чроявлять только окислительные свойства.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
Практические задания
1. К каким электронным семействам откосят элементы-неметаллы?
2. Какие элементы-неметаллы являются биогенными?
3. Какие факторы определяют валентные возможности ато-ыов неметаллов? Рассмотрите их на примере атомов кислорода и серы.
4. Почему одни неметаллы при обычных условиях - газы, другие - твердые тугоплавкие вещества?
5. Приведите примеры простых веществ-неметаллов, существующих при обычных условиях в разном агрегатном состоянии: а) газообразном, б) жидком, в) твердом.
6. Составьте уравнения окислительно-восстановительных реакций с участием неметаллов. Какие свойство (окислительные или восстановительные) проявляют в этих реакциях неметаллы?
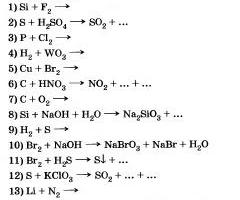
По какой причине очень сильно различаются температуры кипения воды и сероводорода, но близки между собой температуры кипения серо- и селеноводорода?
7. Почему метан устойчив на воздухе, а силен на воздухе самовозгорается: фтороводород устойчив к нагреванию, иодо-водород уже при слабом нагревании разлагается на иод и водород?
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:

9. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:

12. Через раствор, содержащий 10 г едкого натра, пропустили 20 г сероводорода. Какая соль и в какой количестве получится?
Ответ: 0.25 моль NaHS.
14. При обработке 30 г известняка соляной кислотой получилось 11 г углекислого газа. Какова массовая доля карбоната кальция в природном известняке? Ответ: 83.3%.
15. Применяемая в медицине йодная настойкп является 51% ным раствором кристаллического иода в этиловом спирте. Какой объем спирта, плотность которого 0.8 г/мл. требуется для приготовления 250 г такого раствора?
Ответ: 297 мл.
16. Смесь кремния, графита и карбоната кальция.массой 34 г обработали раствором гидроксида натрия п получили 22.4 л газа (н. у.). При обработке такой порции смеси соляной кислотой получили 2.24 л газа (н. у.). Определите массовый состав смеси.
Ответ: 14 г 81: 10 г С; 10 г СаСО2.
17. Газообразный аммиак объемом 2.24 л (н. у.) поглощен 20 г раствора фосфорной кислоты с массовой долей 49%. Какая соль образовалась, какова ее масса?
Ответ: 11,5г
19. Какой объем аммиака требуется для получения 6,3 т азотной кислоты, считая потери в производстве равными 5%?
Ответ: 2352 м3.
20. Из природного газа объемом 300 л (н. у.) с объемной долей метана в газе 96% получили ацетилен. Определите его объем, если выход продукта 65%.
Ответ: 93.6 л.
21. Определите структурную формулу углеводорода с плотностью паров по воздуху 1,862 и массовой долей углерода 88,9%. Известно, что углеводород взаимодействует с аммиачным раствором оксида серебра.
Роль неметаллов в жизни человека
Неметаллы в жизни человека играют огромную роль, так как без них невозможна жизнь не только человека, но и других живых организмов. Ведь благодаря таким неметаллическим элементам, как кислород, углерод, водород и азот, образуются аминокислоты, из которых затем образуются белки, без чего не может существовать все живое на Земле.
Давайте внимательно рассмотрим картинку внизу, на которой представлены основные неметаллы:

А теперь давайте рассмотрим некоторые неметаллы более подробно и узнаем их значение, которое они играют в жизни человека и в его организме.
Полноценная жизнь человека зависит от воздуха, которым он дышит, а в воздухе содержатся неметаллы и соединения между ними. Обеспечением важнейших функций нашего организма, занимается кислород, а азот и другие газообразные вещества его разбавляют, и тем самым защищают наши дыхательные пути. Ведь, с курса биологий вам уже известно, что все защитные функции организма тесно связаны с наличием кислорода.
От проникновения губительного УФ излучения, на защиту нашего организма становиться озон.
Такой необходимый микроэлемент, как сера, в организме человека выступает в роли минерала красоты, так как благодаря ней, кожа, ногти и волосы, будут оставаться здоровыми. Также, не стоит забывать, что сера принимает участие в формировании хрящевой и костных тканей, помогает улучшить работу суставов, укрепляет нашу мышечную ткань и выполняет еще много других функций, которые очень важны для здоровья человека.
Анионы хлора также играют важную биологическую роль для человека, так как принимают участие в активизации некоторых ферментов. С их помощью поддерживается благоприятная среда в желудке и поддерживается осмотическое давление. Хлор, как правило, попадает в организм человека, благодаря поваренной соли при приеме пищи.
Помимо важных качеств, которые неметаллы оказывают на человеческий организм, и другие живые организмы, эти вещества применяют и в других различных отраслях.
Применение неметаллов
Водород
Такая разновидность неметаллов, как водород, широко применяется в химической промышленности. Его используют для синтеза аммиака, метанола, хлороводорода, а также для гидрогенизации жиров. Также, не обойтись без участия водорода, в качестве восстановителя и при производстве многих металлов и их соединений.
Широко применяется водород и в медицине. При обработке ран и для остановки мелких кровотечений используют трех процентный раствор перекиси водорода.
Хлор
Для производства соляной кислоты, каучука, винилхлорида, пластмасс, а также и многих органических веществ, применяют хлор. Его используют в таких промышленностях, как текстильная и бумажная, в качестве отбеливающего средства. На бытовом уровне, хлор незаменим для обеззараживания питьевой воды, так как, обладая окислительными свойствами, он имеет сильное дезинфицирующее действие. Такими же свойствами обладают и хлорная вода, и известь.
В медицинских целях, как правило, в качестве физраствора, используется хлорид натрия. На его основе производят многие водорастворимые лекарства.
Сера
Такой неметалл, как сера, используют для производства серной кислоты, пороха, спичек. Также он применяется при вулканизации каучука. Ее применяют в производстве красителей и люминофоров. А коллоидная сера необходима в медицине.
Сера нашла применение и в сельском хозяйстве. Ее используют, как фунгицид, для борьбы с различными вредителями.
В синтезе полимерных материалов, а также для изготовления различных медицинских препаратов, широкое применение получили и такие неметаллы, как йод и бром.
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления - характерный признак ОВР.
Протекание химических реакций в целом обусловлено обменом частицами между реагирующими веществами. Часто обмен сопровождается переходом электронов от одной частицы к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
Zn (т) + CuSO 4 (р) = ZnSO 4 (p) + Cu (т)
электроны от атомов цинка переходят к ионам меди:
Zn (т) = Zn 2+ (p) + 2e ,
Cu 2+ (р) + 2e = Cu (т) ,
или суммарно: Zn (т) + Cu 2+ (р) = Zn 2+ (p) + Cu (т) .
Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением . Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Для удобства описания окислительно-восстановительных реакций используют понятие степени окисления (n) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов). Следует помнить, что величина n выражается не в кулонах, а в количестве отданных (принятых) электронов. Заряд одного электрона равен –1.60218·10 -19 Кл.
Протекание окислительно-восстановительныхреакций сопровождается изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем , вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
1. степень окисления элемента в простом веществе равна нулю;
2. алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
3. алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
4. отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
5. максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической таблице Д.И. Менделеева.
6. В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая степень окисления
7. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные степени окисления
8. Постоянную степень окисленности в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы (+2)
9. При определении степени окисления предпочтение отдают элементу, который располагается в таблице выше. Например, в CaO 2: n(Сa) = +2, n(О) = - 1
10. степень окисленности кислорода в соединениях равна –2 , за исключением пероксидов (-1) и фторида кислорода OF 2 (+2).
11. водород проявляет степень окисленности +1 во всех соединениях, кроме гидридов металлов (NaH, CaH 2 и т.п.), где степень окисленности равна –1;
Ряд элементов в соединениях проявляют постоянную степень окисления, что используют при определении степеней окисления других элементов:
1) фтор, имеющий наивысшую среди элементов электроотрицательность, во всех соединениях имеет степень окисления –1;
2) водород в соединениях проявляет степень окисления +1, кроме гидридов металлов (–1);
3) металлы IA подгруппы во всех соединениях имеют степень окисления +1; 4) металлы IIA подгруппы, а также цинк и кадмий во всех соединениях имеют степень окисления +2;
4) степень окисления алюминия в соединениях +3;
5) степень окисления кислорода в соединениях равна –2, за исключением соединений, в которых кислород присутствует в виде молекулярных ионов: О 2 + , О 2 - , О 2 2 - , О 3 - , а также фторидов O x F 2 .
Степени окисления атомов элементов в соединении записывают над символом данного элемента, указывая вначале знак степени окисления, а затем ее численное значение, например, 4 , в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe 2+ , SO 4 2– .
Окислительно-восстановительные свойства атомов различных элементов проявляются в зависимости от многих факторов, важнейшие из которых – электронное строение элемента, его степень окисления в веществе, характер свойств других участников реакции. Соединения, в состав которых входят атомы элементов в своей максимальной (положительной) степени окисления, например, K O 4, K 2 2 O 7 , H O 3 , O 2 , могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например, H 3 , H 2 , H , могут только окисляться и выступать в качестве восстановителей. Вещества, содержащие элементы в промежуточных степенях окисления, например H O 2 , H 2 , , , Cl 3 , O 2 , обладают окислительно-восстановительной двойственностью . В зависимости от партнера по реакции такие вещества способны и принимать, и отдавать электроны. Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу. Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие соединения переходят окислитель и восстановитель.
Важнейшие окислители. Галогены, восстанавливаясь, приобретают степень окисления –1, причем от фтора к йоду их окислительные свойства ослабевают (F 2 имеет ограниченное применение вследствие высокой агрессивности):
2H 2 O + 2F 2 = O 2 + 4HF
Кислород O 2 , восстанавливаясь, приобретает степень окисления –2:
4Fe(OH) 2 + O 2 + 2H 2 O = 4 Fe(OH) 3
Азотная кислота HNO 3 проявляет окислительные свойства за счет азота в степени окисления +5:
3Сu + 8HNO 3 (разб) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
При этом возможно образование различных продуктов восстановления:
NO 3 – + 2H + + e = NO 2 + H 2 O
NO 3 – + 4H + + 3e = NO + 2H 2 O
NO 3 – + 5H + + 4e = 0,5N 2 O + 2,5H 2 O
NO 3 – + 6H + + 5e = 0,5N 2 + 3H 2 O
NO 3 – + 10H + +8e = NH 4 + + 3H 2 O
Глубина восстановления азота зависит от концентрации кислоты, а также от активности восстановителя:
Концентрация кислоты
¾¾¾¾¾¾¾¾¾¾¾¾¾
NO 2 NO N 2 O N 2 NH 4 +
¾¾¾¾¾¾¾¾¾¾¾¾¾®
Активность восстановителя
Соли азотной кислоты (нитраты ) могут восстанавливаться в кислотной, а при взаимодействии с активными металлами и в щелочной средах, а также в расплавах:
Zn + KNO 3 + 2KOH K 2 ZnO 2 + KNO 2 + H 2 O
Царская водка – смесь концентрированных азотной и соляной кислот, смешанных в соотношении 1:3 по объему. Название этой смеси связано с тем, что она растворяет даже такие благородные металлы как золото и платина:
Au + HNO 3(конц) + 4HCl (конц) = H + NO+ 2H 2 O
Серная кислота H 2 SO 4 проявляет окислительные свойства в концентрированном растворе за счет серы в степени окисления +6:
C (графит) + 2H 2 SO 4 (конц) СO 2 + 2SO 2 + 2H 2 O.
Состав продуктов восстановления определяется главным образом активностью восстановителя и концентрацией кислоты:
SO 4 2– + 4H + + 2e = SO 2 + 2H 2 O
SO 4 2– + 8H + + 4e = S+ 4H 2 O
SO 4 2– +10H + + 8e = H 2 S + 4H 2 O
Концентрация кислоты
¾¾¾¾¾¾¾¾¾¾¾¾¾
¾¾¾¾¾¾¾¾¾¾¾¾¾
Активность восстановителя
и их соли часто используются как окислители, хотя многие из них проявляют двойственный характер. Как правило, продуктами восстановления этих соединений являются хлориды и бромиды, а также йод:
MnS + 4HСlO = MnSO 4 + 4HCl;
5Na 2 SO 3 + 2HIO 3 = 5Na 2 SO 4 + I 2 + H 2 O
Перманганат калия KMnO 4 проявляет окислительные свойства за счет марганца в степени окисления +7. В зависимости от среды, в которой протекает реакция, он восстанавливается до разных продуктов: в кислотной среде – до солей марганца (II), в нейтральной – до оксида марганца (IV) в гидратной форме MnO(OH) 2 , в щелочной – до манганат-иона MnO 4 2– :
кислотная среда:
5Na 2 SO 3 +2KMnO 4 + 3H 2 SO 4(разб) = 5 Na 2 SO 4 + 2MnSO 4 +3H 2 O+K 2 SO 4
нейтральная среда:
3Na 2 SO 3 + 2KMnO 4 + 3H 2 O = 3Na 2 SO 4 + 2MnO(OH) 2 ¯+ 2KOH
щелочная среда:
Na 2 SO 3 + 2KMnO 4 + 2KOH = Na 2 SO 4 + 2K 2 MnO 4 + H 2 O
Дихромат калия K 2 Cr 2 O 7 , в состав молекулы которого входит хром в степени окисления +6, является сильным окислителем при спекании и в кислотном растворе:
6KI + K 2 Cr 2 O 7 + 7H 2 SO 4 (разб) = 3I 2 + Cr 2 (SO 4) 3 + 7H 2 O + 4K 2 SO 4
проявляет окислительные свойства и в нейтральной среде:
3H 2 S + K 2 Cr 2 O 7 + H 2 O = 3S¯ + 2Cr(OH) 3 ¯ + 2KOH.
Среди ионов окислительные свойства проявляют ион водорода Н + и ионы металлов в высшей степени окисления. Ион водорода Н + выступает как окислитель при взаимодействии активных металлов с разбавленными растворами кислот (за исключением HNO 3): Mg + H 2 SO 4 (разб) = MgSO 4 + H 2
Ионы металлов в относительно высокой степени окисления, такие, как Fe 3+ , Cu 2+ , Hg 2+ , восстанавливаясь, превращаются в ионы более низкой степени окисления:
H 2 S + 2FeCl 3 = S¯ + 2FeCl 2 + 2HCl
или выделяются из растворов их солей в виде металлов:
2Al + 3CuCl 2 = 2AlCl 3 + 3Cu.
Важнейшие восстановители. К типичным восстановителям среди простых веществ относятся активные металлы, такие как щелочные и щелочно-земельные металлы, цинк, алюминий, железо и др., а также некоторые неметаллы (водород, углерод, фосфор, кремний): Zn + 2HCl = ZnCl 2 + H 2
C + 4HNO 3(конц, гор) = CO 2 + 4NO 2 + 2H 2 O
Восстановительными функциями обладают бескислородные анионы, такие как Cl - , Br - , I - , S 2 - , H - , и катионы металлов в низшей степени окисления:
2HBr (конц) + Н 2 O 2(конц) = Br 2 + 2H 2 O;
2CaH 2 + TiO 2 2CaO + Ti +2H 2 .
2FeSO 4 + H 2 O 2(конц) + H 2 SO 4(разб) Fe 2 (SO 4) 3 + 2H 2 O.
Окислительно-восстановительная двойственность. Среди простых веществ окислительно-восстановительная двойственность характерна для элементов VIIA, VIA и VA подгрупп, которые могут как повышать, так и понижать свою степень окисления.
Часто используемые как окислители, галогены под действием более сильных окислителей проявляют восстановительные свойства (за исключением фтора). Их окислительные способности уменьшаются, а восстановительные способности увеличиваются от Cl 2 к I 2 . Эту особенность иллюстрирует реакция окисления йода хлором в водном растворе: I 2 + 5Cl 2 + 6H 2 O = 2HIO 3 + 10HCl.
Кислородсодержащие кислоты галогенов и их соли , в состав молекул которых входит галоген в промежуточной степени окисления, могут выступать не только в роли окислителей:
S + NaClO 2 NaCl + SO 2
но и восстановителей:
5NaClO 2 + 2KMnO 4 + 3H 2 SO 4 (разб) = 5NaClO 3 + 2MnSO 4 + 3H 2 O + K 2 SO 4
Пероксид водорода , содержащий кислород в степени окисления –1, в присутствии типичных восстановителей проявляет окислительные свойства, т.к. кислород может понижать свою степень окисления до –2:
2KI + H 2 O 2 = I 2 + 2KOH
а при взаимодействии с сильными окислителями проявляет свойства восстановителя (степень окисления кислорода возрастает до 0):
H 2 O 2 +2Hg(NO 3) 2 = O 2 + Hg 2 (NO 3) 2 + 2HNO 3 .
Азотистая кислота и нитриты , в состав которых входит азот в степени окисления +3, также могут выступать как в роли окислителей: 2HI + 2HNO 2 = I 2 + 2NO + 2H 2 O,
так и в роли восстановителей: 2NaNO 2(разб, гор) + O 2 = 2NaNO 3 .
Влияние кислотности среды на вид продуктов реакции особенно ярко реализуется на примере восстановления перманганатного иона MnO 4 - .
а) в кислотной среде , в соответствии с первой схемой, протекает наиболее глубокое восстановление атома марганца.
MnO 4 - + 8H + +5e - →Mn 2+ +4 Н 2 О.
При этом образуются соли марганца(II), анион которых зависит от кислоты, создающей кислотную среду. Так, в сернокислотной среде образуетсяMnSO 4 , в солянокислойMnCl 2 . Отметим, что металлический марганец образоваться не может, т.к. этот металл в ряду напряжений металлов находится существенно левее водорода и окисляется ионамиH + . б)в нейтральной (слабощелочной или слабокислой среде) перманганат-ион восстанавливается до диоксида марганцаMnO 2 , выпадающего из раствора в виде черно-бурого осадка
MnO 4 - + 2Н 2 О + 3е - →MnO 2 + 4ОН - .
В этом случае происходит существенное защелачивание раствора.
в) в сильно щелочной среде перенос электронов осуществляется с большими затруднениями (из-за большой концентрации отрицательно заряженных ионов ОН -). Восстановление происходит до манганатного ионаMnO 4 2- , имеющего зеленую окраску:
MnO 4 - +1е - → MnO 4 2-
Определенную внимательность надо проявлять при работе с соединениями хрома (VI). Дело в том, что устойчивый в кислотной среде дихромат-ионCr 2 O 7 2- ,имеющий свойства сильного окислителя, в щелочной среде,без изменения степени окисления , превращается в хромат-ионCrO 4 2- , проявляющий очень слабые окислительные свойства.
Cr 2 O 7 2- + 2ОН - → 2CrO 4 2- + Н 2 О
Напротив, хромат в кислотной среде образует дихромат.
2CrO 4 2- + 2Н + →Cr 2 O 7 2- + Н 2 О
В кислотной среде ион Cr 2 O 7 2- восстанавливается до ионовCr 3+ :
Cr 2 O 7 2- + 14H + +6e - →2Cr 3+ +7 Н 2 О.
В зависимости от конкретного восстановителя и реальных кислотно-основных параметров раствора хром может восстанавливаться или до осадка Cr(OН) 3 , или, вследствие амфотерных свойств соединений хрома (III), до растворимого комплексного аниона 3- . В любом случае, степень окисления в продуктах восстановления хрома всегда будет равна +III.
С другой стороны, если окисление соединений хрома проводится в щелочной среде, то продуктов окисления будут хроматные ионы CrO 4 2- , если же окисление происходит в кислотной среде, то будут образовываться ионыCr 2 O 7 2- .
Влияние концентрации на состав продуктов реакции
Влияние концентрации реагирующих веществ в ОВР наиболее ярко проявляется на примере реакций с азотной и серной кислотами.
Реакции азотной кислоты .
Напомним, что эти кислоты одновременно является и окислителями, и создателями среды.
Азотная кислота реагирует, как окислитель, с металлами, оксидами и гидроксидами металлов в промежуточных степенях окисления, с неметаллами и их оксидами, содержащих неметалл в промежуточной степени окисления. Как правило, продукты восстановления азотной кислоты образуют смесь веществ (как правило, оксидов), но, в зависимости от концентрации, тот или иной продукт будет преобладать в реакционной смеси. Экспериментальным путем были установлены следующие закономерности:
Концентрированная азотная кислота восстанавливается доNO 2 .
NO 3 - + 2H + +1e - → NO 2 + H 2 O
Умеренно разбавленная азотная кислота восстанавливается доNO .
NO 3 - + 4H + +3e - →NO+ 2H 2 O
Очень разбавленная азотная кислота, реагируя с активным восстановителем (Mg,Ca,Alи т.п.) восстанавливается до соли - нитрата аммонияNH 4 NO 3 .
NO 3 - + 10H + +8e - →NH 4 + +3H 2 O
В состав продуктов восстановления могут также входить газообразный азот N 2 , N 2 O.
1. В атмосфере фтора горят такие стойкие вещества,
как стекло (в виде ваты), вода. Один из продуктов горения - кислород, т. е. фтор как окислитель сильнее кислорода:
SiO2 + 2F2 → SiF4 + O2;
2H2O + 2F2 → 4HF + O2.
2. Активно взаимодействует фтор с большинством простых веществ. С серой и фосфором он взаимодействует даже при температуре жидкого воздуха(−190°С):
S + 3F2 → SF6;
2P + 5F2 → 2PF5.
Фтор окисляет даже некоторые инертные газы (ксенон),
но не взаимодействует с гелием, неоном и аргоном:
Xe + 2F2 → XeF4.
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений - фторопластов, и с большинством из них - с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором - Al, Mg, Cu, Ni.
Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
2CoF3 → 2CoF2 + F2
MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1
химикам удалось получить дифторид кислорода, образующийся при действии фтора на слабый раствор щелочи:
2F2 + 2NаОН = 2NаF + OF2 + H2O.
С азотом фтор непосредственно не соединяется, но косвенным путем известному специалисту по фтору Отто Руффу удалось получить в 1928 г. трифторид азота NF3. Известны и другие азотсодержащие соединения фтора. Сера под его действием при доступе воздуха воспламеняется. Древесный уголь загорается в атмосфере фтора при обычной температуре.
Серебро и золото на холоде взаимодействуют с фтором очень медленно, а при накаливании сгорают в нем. Платина при обычных условиях не реагирует с фтором, но сгорает в нем при нагревании до 500–600 °С.
С бором, кремнием, фосфором, мышьяком Фтор взаимодействует на холоду, образуя соответствующие фториды.
При взаимодействии Фтора с оксидами металлов на холоду образуются фториды металлов и кислород; возможно также образование оксифторидов металлов (например, MoO2F2). Оксиды неметаллов либо присоединяют Фтор, например SO2 + F2 = SO2F2, либо кислород в них замещается на Фтор, например SiO2 + 2F2 = SiF4 + О2. Стекло очень медленно реагирует с Фтором;. Оксиды азота NO и NO2 легко присоединяют Фтор с образованием соответственно фтористого нитрозила FNO и фтористого нитрила FNO2. Оксид углерода (II) присоединяет Фтор при нагревании с образованием фтористого карбонила: СО + F2 = COF2.
Гидрооксиды металлов реагируют с Фтором, образуя фторид металла и кислород, например 2Ва(ОН)2 + 2F2 = 2BaF2 + 2Н2О + О2. Водные растворы NaOH и KOH реагируют с Фтором при 0°С с образованием OF2.
Галогениды металлов или неметаллов взаимодействуют с Фтором на холоду, причем Фтор замещает все галогены.
Легко фторируются сульфиды, нитриды и карбиды. Гидриды металлов образуют с Фтором на холоду фторид металла и HF; аммиак (в парах) - N2 и HF. Фтор замещает водород в кислотах или металлы в их солях, например НNО3(или NaNO3) + F2 = FNO3 + HF (или NaF); в более жестких условиях Фтор вытесняет кислород из этих соединений, образуя сульфурилфторид, например Na2SO4 + 2F2 = 2NaF +SO2F2 + O2. Карбонаты щелочных и щелочноземельных металлов реагируют с Фтором при обычной температуре; при этом получаются соответствующий фторид, СО2 и О2.
Фтор энергично реагирует с органических веществами.
Фтор получают в свободном состоянии электролизом
его расплавленных соединений (HF в расплавленном дигидрофториде калия KH2F3).
Источником для производства Фтора служит фтористый водород, получающийся в основном либо при действии серной кислоты H2SO4· на флюорит CaF2, либо при переработке апатитов и фосфоритов.. или разложением высших фторидов
2CeF4= 2CeF3+ F2
Соединяясь с водородом, фтор образует газообразное соединение – фтороводород НF . Водные растворы фтороводорода называют плавиковой кислотой. Газообразный НF – бесцветный газ с резким запахом, очень вредно действующий на дыхательные органы и слизистые оболочки.
Получение Обычный способ его получения - действие серной кислоты на плавиковый шпат СаF2:
СаF2 + Н2SО4 = СаSO4 + 2НF.
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
Н2 + F2 → 2HF.
Молекула фтороводорода сильно полярна, μ = 0,64·10−29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии, фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи, термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама - самого тугоплавкого из металлов). Для сравнения - у воды термический распад становится заметным при температурах выше 2000 °C.
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Плавиковая кислота. Химические свойства действует на все металлы, за исключением золота и платины. На медь и серебро плавиковая кислота действует очень медленно. Слабые растворы ее совершенно не действуют на олово, медь и бронзу.
Устойчив к плавиковой кислоте и свинец, который покрывается слоем фторида свинца, предохраняющим металл от дальнейшего разрушения. Поэтому свинец и служит материалом для аппаратуры в производстве плавиковой кислоты.
Склонность молекул НF к ассоциации приводит к тому, что кроме средних солей фтороводородной кислоты известны и кислые, например КНF2 (из нее электролизом получают фтор). В этом заключается ее отличие от других галогеноводородных кислот, дающих только средние соли.
Характерная особенность плавиковой кислоты, отличающая ее от всех других кислот, – чрезвычайно легкое ее действие на кремнезем SiO2 и соли кремниевой кислоты:
SiO2 + 4НF = SiF4 + 2H2O.
Тетрафторид кремния SiF4 – газ, улетучивающийся при реакции.
Действуя на кремнезем, входящий в состав стекла, плавиковая кислота разъедает стекло, поэтому хранить ее в стеклянных сосудах нельзя.
Из органических веществ плавиковая кислота действует на бумагу, дерево, пробку, обугливая их. На пластик действует слабо, совершенно не действует на парафин, чем и пользуются при хранении плавиковой кислоты в сосудах, сделанных из этого материала.
Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
МО + 2HF = MF2 + Н2О
Жидкий HF - сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
HCl + 2HF ↔ ClH2+ + HF2−
В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид ионов, например BF3, SbF5:
BF3 + 2HF → FH2+ + BF4−
Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
3NaF + AlF3 → 3Na+ + AlF6−
(AlF3 - как кислота)
AlF3 + 3BF3 → Al3+ + 3BF4−
(AlF3 - как основание)
Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF.
ОПРЕДЕЛЕНИЕ
Фтор – элемент, относящийся к группе галогенов. Расположен во втором периоде VII группы A подгруппы. Обозначение – F.
Фтор - неметалл. Самый электроотрицательный элемент. В обычных условиях фтор представляет собой газ бледно-желтого цвета. Ядовит.
В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
Молекула фтора двухатомна F 2 . Обладает самой низкой поляризуемостью среди галогенов. Температура плавления фтора аномально низкая. Не растворим в воде, т.к. разлагает ее (2F 2 + 2H 2 O = 4HF + O 2).
Степень окисления фтора в соединениях
Фтор образует двухатомные молекулы состава F 2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю .
Фтор характеризуется наибольшим значением электроотрицательности, в своих соединениях он всегда имеет постоянную отрицательную степень окисления равную (-1) (HF -1 , OF -1 2 , NaF -1 и т.д.).
Примеры решения задач
ПРИМЕР 1
| Задание | В нитридах азот проявляет степень окисления -3. Составьте формулы нитрида лития, нитрида бария и нитрида кремния. |
| Решение | Известно, что литий проявляет степень окисления (+1). Для того, чтобы составить формулу соединения запишем обозначения химических элементов и укажем степени их окисления:
Аналогичным образом составляем формулы нитрида бария и нитрида кремния. Они будут иметь следующий вид: Ba 2 N 3 и Si 3 N 4 . |
| Ответ | Li 3 N, Ba 2 N 3 и Si 3 N 4 . |
ПРИМЕР 2
| Задание | В карбидах углерод проявляет степень окисления -4. Составьте формулы карбидов кальция и алюминия. |
| Решение | Известно, что кальций и алюминий проявляют степени окисления (+2) и (+3), соответственно. Это единственные значения степеней окисления, характерные для данных химических элементов. Для того, чтобы составить формулу соединения запишем обозначения химических элементов и укажем степени их окисления:
Затем найдем наименьшее общее кратное (знак «-» или «+» не учитываем): Разделим полученное значение на величину степени окисления, а полученные цифры запишем в виде индексов, указывающих количество атомов каждого элемента в составе молекулы: |
| Ответ | CaC 2 и Al 4 C 3 . |
