Подробности
До сих пор существуют различные мнения о природе углеродных тел, стоящих как бы между органическими и неорганическими образованиями. По крайней мере, большинство исследователей считает, что различные формы углерода (кристаллические и переходные) представляют собой высокомолекулярные соединения - гомоцепные неорганические полимеры углерода.
Позже эти тяжелые элементы будут конденсироваться в новые звезды или планеты, наряду с легкими элементами, синтезированными во время тихой жизни звезды, прежде чем она взрывается, в том смысле, что мы «пыль пыли». «звезды», образованные из пепла ядерных реакций, которые до взрыва перенесли жизнь древних звезд.
Наконец, мы заканчиваем тем, что звездное сердце превращается в нейтронную звезду и оболочку, которая взорвалась. Он будет светиться необыкновенным светом, как сотня галактик, собранных в течение короткого времени, а затем будет ярче, чем галактика, в течение первых трех-четырех месяцев ее существования.
Хорошо известны две кристаллические формы углерода, встречающиеся в природе, - алмаз и графит.
В настоящее время разработаны различные способы получения искусственных алмазов, в том числе и с новыми качествами, расширяющими диапазон их применения . Например, в электронике благодаря своей исключительной стабильности алмаз является перспективным электродным материалом для теоретической и прикладной электрохимии. В медицине разработаны ультрадисперсные алмазы детонационного синтеза как средство коррекции перекисного окисления белков при злокачественном росте (лимфосаркомы). Они используются при создании лекарственных препаратов пролонгированного действия. В химии алмаз предполагают использовать в качестве перспективного носителя для гетерогенных катализаторов, хроматографических сорбентов, присадок к топливам.
Что происходит с звездными сердцами с массой более 3 МБ?
Пояснения, представленные до сих пор, верны, если масса звездного сердца составляет от 4 до 3 МБ. Ниже 4 МБ, мы знаем, смерть звезды приводит к белой карлике. Это будет наш Солнце. Здесь гравитационная сила звездного сердца больше, чем давление дегенерации нейтронов. Последний теперь неспособен уравновешивать гравитацию: сердце рушится бессознательно на себе и становится черной дырой. Это полная победа тяготения, потому что ничто не может остановить крах материи, что контракты до бесконечной плотности, бесконечная температура, все в одной точке пространства: это называется «сингулярностью».
В результате исследования была открыта новая кристаллическая форма углерода, названная карбпиом, и кумулены - линейные полимеры углерода . Карбин способен существовать в виде длинных цепей с умеренной конформационной жесткостью. Кумулены, как правило, представляют собой олигомерные соединения . Искусственным путем был получен лонсдегшит, впоследствии обнаруженный в составе метеоритов. В конце двадцатого столетия открыты новые аллотропические модификации, такие, как фуллерены и углеродные нанотрубки.
В черной дыре даже скорости света недостаточно!
Черная дыра не имеет материальной поверхности, а представляет собой математическую поверхность, называемую «горизонт». Его радиус называется «луч Шварцшильда». Ничто не может выходить из черной дыры, даже не свет: оно невидимо. Все, что проникает в черную дыру, будь то пыль, целые звезды, светящиеся фотоны, не может выйти из нее.
Углеводы являются важной группой природных веществ. Мы можем разделить их на три большие группы. В этой статье мы представим первую группу углеводов, которую мы называем моносахаридами. Они вместе с другой группой являются сахарами. Поэтому мы знаем, что углеводы и сахара не совсем то же самое.
В основном состоянии углерод имеет электронную конфигурацию Is 2s 2p , в том числе два валентных (2р) электрона . В большинстве случаев в химических реакциях углерод проявляет себя как четырехвалентный элемент, что связано с переходом электрона с 25-орбитали на 2/?-орбиталь по схеме:
Для четырехвалентного углерода известны три валентных состояния, соответствующие sp -, sp -, ^-гибридизации электронов атомов углерода. Этим валентным состояниям соответствуют кристаллические формы трех гибридных разновидностей атомов углерода - алмаз, графит и карбин.
Эта большая группа природных веществ очень важна для животных. Это три-семь атомов углерода, атомы водорода и атомы кислорода. Вот почему их называли углеводами. Чтобы сделать их немного запутанными, мы делим их на группы по двум критериям. Первое деление основано на количестве атомов углерода - триозе, тетрозе, пентозе, гексозе, гептозе. Второе деление основано на содержащейся карбонильной группе - альдозе и кетозе.
Рис. 2 Карбонильные группы - общие формулы. Моносахариды могут отображаться с использованием трех типов формул. Чтобы упростить и упростить формулы, атомы углерода не отражаются в них, но на каждом пересечении больше связей с атомом углерода скрыты. Формулы Фишера просты, но очень упрощены, поскольку они не включают пространственное расположение молекулы.
- В рецептурах Толленса описывается циклическая форма моносахаридной молекулы.
- Формулы Хауорта более точно показывают пространственное расположение молекулы.
- Пятициклический цикл называется фуранозой, шестимерной пиранозой.
- Используя эти формулы, мы также показываем олигосахариды и полисахариды.
Алмаз представляет собой пространственный полимер, состоящий из атомов углерода s/Лгибридизации с тетраэдрическим расположением валентных связей.
Графиту соответствует паркетный полимер, построенный из атомов углерода s/Лгибридизации, расположенных в одной плоскости.
В карбине, имеющем линейную полимерную цепочку пальминово-го (-С=С-)„ или кумуленового (=С=С=С=)„ типов реализуется 5р-гибридное состояние атомов углерода. Следует отметить, что в углероде простая бт-связь прочнее, чем 7г-компоненты кратных связей С=С или С=С, что отражается на свойствах аллотропных форм углерода. Известно также большое число так называемых переходных форм углерода, аморфных и частично-кристаллических.
Все моносахариды, за исключением дигидроксиацетона, содержат в своей структуре по меньшей мере один углерод, имеющий четыре различных заместителя. Это означает, что у него вокруг него четыре общности, и с каждой связью есть что-то еще. Мы называем этот углерод хиральным углеродом.
В форме Хаворта мы выделяем две другие формы. Цикацилирование моносахарида становится его первым хиральным атомом, поэтому мы можем вывести из данного моносахарида два энантиомера: α и β. Присутствие хирального углерода связано с физическим свойством, называемым оптическим вращением. Если моносахарид освещается в растворе поляризованным светом, плоскость этого света поворачивается вправо или влево.
Изучение структуры и свойств переходных форм углерода было проведено В.И. Касаточкиным . Согласно развитой им концепции большое многообразие переходных форм углерода обусловлено сочетанием атомов углерода различного гибридного состояния. К ним относятся всевозможные коксы, продукты термического превращения полимеров, стеклоуглерод, углеродные волокна.
Глицеральдегид имеет три атома углерода, поэтому мы помещаем его в триозную группу. В организме человека это происходит как важное промежуточное звено многих биохимических процессов. Этот моносахарид также может быть включен в триозы, но это самый простой кетоз. Он используется как подсластитель, а также встречается в организме человека главным образом при переваривании углеводов и триацилглицеринов.
Этот моносахарид очень важен для существования жизни на Земле. Этот моносахарид является частью молока матери млекопитающих, для которого он является важным источником энергии. Галактоза превращается в глюкозу в организме. Однако существует наследственное расстройство, которое предотвращает это преобразование, и ребенок не обладает необходимой энергией. Это расстройство называется галактоземией.
Термодинамически углерод наиболее устойчив в кристаллическом состоянии. Переходная форма предполагает возможность превращения углерода. Однако из-за высоких кинетических барьеров углерод в состоянии переходных форм необычайно стабилен и в обычных условиях может существовать бесконечно длительное время. Лишь под воздействием высоких температур происходят структурные превращения углерода.
Этот моносахарид, пожалуй, самый распространенный и самый важный. Другое название называется виноградным сахаром, потому что оно богато виноградом. Мы также можем найти его на каждом зеленом растении, потому что он производится при фотосинтезе, но также в меде, в сладких фруктах, в крахмале, в крови. В медицине это дается как искусственная диета. Потому что это самый быстрый источник энергии для человеческого тела и единственный источник энергии для некоторых органов, таких как мозг. Без этого мы не могли бы существовать.
Поэтому глюкоза поступает в кровь из пищи, откуда она транспортируется там, где это необходимо. Из вашего опыта вы знаете, что в случае нехватки энергии вы не получаете кусок бекона, а только виноградный сахар. И энергия идет почти мгновенно. И как возможно, что уровень глюкозы в крови сохраняется на одном уровне? Они могут использовать два гормона - глюкагон и инсулин. Люди, страдающие от заболевания, обычно называемого диабетом, имеют слишком много глюкозы в крови. Либо они не производят достаточное количество инсулина в организме, либо почему-то перестают работать над рецепторами инсулина, которые его обнаруживают.
На рис. 1.1 представлена схема строения углеродных веществ - не-графитирующегося углерода (а) и искусственного графита (б).

Рис. 1.1. Схема строения углеродных веществ: а - неграфитируюшийся углерод; 6 - искусственный графит
Углерод переходных форм обладает разнообразными ценными фи-зико-химическими и механическими свойствами и имеет большое практическое значение. Широкий диапазон изменения свойств углерода связан с особенностями его структуры. Известны три основных элемента его структуры, а именно турбостратная структура, аморфный углерод и надатомные образования высшего порядка.
Фруктоза называется фруктовым сахаром. Это самый сладкий из всех моносахаридов и может быть найден в спелых фруктах, но также и в меде. Кроме того, он также является частью обычного сахара свеклы, который мы используем дома для подслащивания. Было обнаружено, что если фруктоза используется в избытке, это приводит к ожирению и связанным с этим проблемам со здоровьем. Вот почему мы не должны так гармонизировать.
Чистый углерод происходит в двух модификациях
Авторы: Людмила Липтакова, Яна Пучова. Углерод является основным элементом биосферы, незаменимой частью всех органических соединений. В элементарном состоянии он встречается в природе, как графит или алмаз. Ископаемые вещества богаты углеродом. Алмаз - В структуре атомы связаны твердыми ковалентными связями с плоской центрированной кубической решеткой. Вот почему алмаз - самое сложное природное вещество. Он прозрачный, блестящий, иногда окрашенный примесями.
Турбостратной называется слоистая структура углерода, в которой в отличие от структуры графита отсутствует закономерная ориентация слоев относительно гексагональной оси. Основой турбостратной структуры являются базисные плоскости, строение которых аналогично графитовым плоскостям. Они состоят из шестизвенных ароматических циклов (гексагонов) атомов углерода с тем же межатомным расстоянием (1,415 А), что и в плоскостях графита. Определенное число плоскостей, соединяясь между собой, образует пакеты. В отличие от идеального графита в пакетах турбостратной структуры плоскости расположены под разными углами относительно друг друга. Схема строения углерода с турбостратной структурой изображена на рис. 1.2.
Алмаз чрезвычайно стойкий химически и механически. Практически ничто не растворяется и не реагирует при высоких температурах. Алмаз может быть изготовлен из графита с высокими температурами и давлениями. Графит - кристаллы графита состоят из атомов шестиугольника. Между слоями имеются слабые силы притяжения, поэтому графит мягкий и электрический ток хорошо. С ней можно писать при написании слоев атомов углерода. Графит реагирует с кислотами и окислителями при комнатной температуре. Графит плохо химически и механически устойчив.
Углерод извлекается путем добычи в виде графита и алмазного или ископаемого топлива. Углерод был обнаружен в предыстории. Кокс и уголь используются в качестве топлива и химического сырья. Алмазы используются в ювелирных изделиях после измельчения. Синтетические алмазы используются для обработки твердых материалов. Синтетические алмазы также используются в электротехнике для чипов и процессоров. Графит используется как карандаш для письма. Графит производит электроды, огнеупоры и поверхности подшипников.
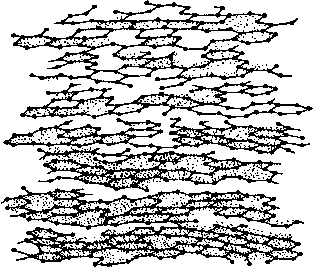
Рис. 1.2. Схема строения двумерноупорядоченного углерода с турбостратной структурой
В строго кристаллографическом понимании пакеты по структуре нельзя отнести к кристаллам, так как в них отсутствует трехмерная упорядоченность. В каждой плоскости пакета существует строгий порядок расположения атомов углерода, поэтому пакеты являются как бы двухмерными кристаллами, что позволяет в литературе турбостратную структуру углерода условно называть кристаллической.
Графит также используется в качестве замедлителя в ядерных реакторах. Технический углерод используется в качестве наполнителя при производстве резины и шин. Активированный уголь используется для адсорбции газа и в медицине. Углерод происходит естественно в земле в виде алмаза и графита, которые стоят на шкале твердости противоположных полюсов.
Интересная геология: минеральная твердость является устойчивость к проникновению инородного тела без разрушения. В зависимости от прочности связей в кристаллической структуре в значительной степени зависит от дефектов в кристаллической решетке. Для определения твердости в общей практике используют Мооса шкала твердости. Эта шкала является лишь приблизительной. Мы контролируем ли минерал или не оставляя следов.
Дальнейшее более полное развитие эти исследования получили в работах Р.Е. Франклина . В углероде переходных форм сосуществуют кристаллические турбостратные структуры и аморфный углерод. Количественное соотношение этих фракций трудно оценить. По данным , в коксе, полученном при термической деструкции поливинилиденхлорида, содержание аморфной фракции достигает 35%. Оно изменяется в зависимости от вида исходного сырья, используемого для получения углерода, условий его получения и конечной температуры обработки.
Результаты могут быть рассмотрены для оценки твердости минералов. Формируются из аморфного углерода, который покрыт подложкой из сапфира пластины. Углерода затем подвергают лазерных импульсов длительностью 200 нс. Все это происходит при атмосферном давлении. Фуллерены являются третьей кристаллической формой углерода, который состоит из сферических молекул С60, расположенных в виде гранецентрированной кубической или простой кубической решетки. Затем было показано, что форма кластера представляет собой тип икосаэдр, который является сферической, поверхность которого образована из 20 шестиугольников и 12 пятиугольников, имеющих атомы углерода углы.
Схема строения неграфитирующегося углеродного вещества по Франклину представлена на рис. 1.1, а; на рисунке прямыми линиями обозначены базисные плоскости, а извилистыми - прослойки аморфного углерода между ними. В отличие от Франклина авторы работы для стеклоуглерода предлагают модель перепутанных лент, соединенных межмолекулярными связями с широким набором энергий. Прямые участки лент имеют размер около 100 А, соизмеримый со значением L
Графен состоит из одного или более чем двух слоев атомов углерода, расположенных в виде правильной шестиугольной структуры. Его толщина в миллион раз меньше человеческого волоса. Графен представляет собой материал с высокой прочностью, эластичностью, гибкостью, электропроводностью, отличной прозрачностью и кроме того, может эффективно поглощать кинетическую энергию, чем сталь. двухслойная структура графена ведет себя как полупроводник, который можно регулировать с помощью электрических полей. Метод, используемый для получения графена называется отшелушивание и это не что иное, как обнажать тонких слоев графита с использованием обычной клейкой ленты.
Определенным рентгеновским методом. Высота пакетов равна 40 А, что совпадает со значением L
Ленты неплотно упакованы, пронизаны порами, поэтому стеклоуглерод характеризуется низкой плотностью (1,45 г/см). В стеклоуглероде допускается наличие разветвленных лент.
Стеклоуглерод представляют и докембрийские шунгитовые породы, содержащие древнейший (2 млрд лет) некристаллический углерод .
Недостатком приведенных схем является то, что они не объясняют природу связей между лентами в направлении, перпендикулярном их плоскости. Большинство исследователей считают, что углерод находится только в тригональном состоянии, и плоскости между собой соединены не химическими, а слабыми межмолекулярными связями Ван-дер-Ваальса.
Можно представить иную надатомную организацию углерода , где турбостратные пакеты, а не отдельные слои могут быть теми структурными единицами, которые участвуют в построении структур высшего порядка. Пакеты связаны между собой различными гибридными формами аморфного углерода и образуют пространственный полимер. В процессе формирования ароматических сеток и их воссоединения в турбостратные пакеты на стадии карбонизации возникают пограничные.
дефекты, в том числе свободные валентности углерода, к которым присоединяются амор-фные цепи углерода, связывающие пакеты между собой. Схематически подобная структура углерода показана на рис. 1.3.
Аналогичная структурная схема была предложена В. И. Касаточкиным для витрена.
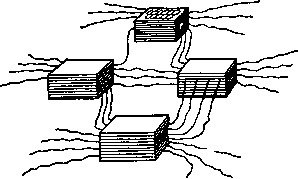
Рис. 1.3. Пространственная модель структур высшего порядка углерода
Cтраница 4
Атомы углерода способны соединяться друг с другом, образуя более сложные молекулы, но в отличие от Н2, С2 или Na, которые насыщены и слабо притягиваются друг к другу, а потому при обычных условиях газообразны, молекулы углерода не насыщены и чрезвычайно склонны к конденсации в твердое состояние; они остаются газообразными лишь при очень высоких температурах.
То обстоятельство, что здесь, как и во всех реакциях, во взаимодействие вступают молекулы, не при-нято в расчет; если же принять во внимание, что молекула представляет соединение однородных атомов, что, может быть, даже молекула углерода состоит из многих углеродных атомов, на что, невидимому, указывает ее постоянство, то оправдывается допущение, что отделению этих углерод - ных атомов друг от друга, предшествующему их соединению с кислородом, соответствует термический эффект - по всей вероятности, поглощение тепла, тогда как при горении окиси углерода в реакции принимает участие отдельный атом углерода. Точно так же образование воды указывает на два (а может быть и на три, если принять молекулу кислорода 02) момента: разделение атомов водорода, ранее связанных в молекулы, и соединение их с кислородом. Каждому из этих моментов должен соответствовать термический эффект.
По полученным данным нельзя сделать однозначный вывод о составе пара углерода над карбидами, однако тот факт, что при расчете реакции (18) на Сз получаем для аш значение больше 1, говорит в пользу того, что над карбидами в области исследуемых температур преобладают атомы, а не молекулы углерода.
В Берклеевской национальной лаборатории (США) создана новая форма твердого углерода Сзб - Его молекула состоит из 36 атомов углерода. Молекулы углерода С36 возникают вместе с фуллеренами С60 в пламени дугового разряда между двумя графитовыми электродами. Исследователи полагают, что молекулы С3 & могут обладать интересными электрическими и химическими свойствами.
Спектрами лунных извержений, вероятно, заинтересуются астробиологи. Ведь молекулы углерода, азота, во - дорода, выходящие из лунных кратеров, дают основание полагать, что в недрах нашего спутника немало органических соединений.
Будет ли устойчива молекула углерода состава Сг. Какую кристаллическую решетку образуют атомы углерода в алмазе и графите.
Это объясняется полимерным строением молекул углерода, поэтому и графит, и алмаз, состоящие из одинаковых, только углеродных атомов, относят к полимерам. Любой кристалл алмаза представляет собой, по существу, идеально построенный трехмерный полимер. В графите полимерная упорядоченность распространяется только по плоскости. Существуют и одномерные (линейные) полимеры углерода: карбин и поликумулен. В настоящее время понятие фуллерены применяется к широкому классу многоатомных молекул углерода Сп (п от 24 и более) и твердым телам на их основе. Однако еще несколько лет назад фуллереном (точнее бакминстерфуллереном) называли молекулу Сео, атомы которой располагаются на поверхности сферы в вершинах 12 равносторонних пятиугольников и 20 равносторонних шестиугольников. Ее радиус составляет 0 357 нм. Уникальные свойства фуллеренов привлекают внимание ученых всего мира.
Повышение светимости факела объясняется тем, что при нагреве углеводородных газов происходит их распад на более простые соединения - атомарный углерод и водород. В связи с недостатком кислорода молекулы углерода образуют мельчайшие частицы твердого углерода (сажи), которые, раскаляясь, придают пламени светимость.
Сольватация рассматривается на молекулярном уровне и включает всю совокупность взаимодействий, осуществляющихся в растворе, которые в зависимости от свойств растворителя и растворенного вещества могут иметь различную природу и проявляться по-разному. Например, сольватация молекул иода молекулами четы-реххлористого углерода, молекул фосфора или серы молекулами сероуглерода осуществляется исключительно за счет слабого ван-дерваальсова взаимодействия, но все же энергия сольватации оказывается больше, чем энергия взаимодействия частиц в молекулярных кристаллах растворяющихся веществ. Как правило, из таких молекулярных растворов растворитель легко удаляется, а растворенное вещество остается в химически неизменном виде. При испарении растворителей из перечисленных растворов можно получить хорошо образованные кристаллы иода, фосфора, серы.
